උච්ච වායු
උච්ච වායු යනු සම්මත තත්ත්ව යටතේ අඩු රසායනික ප්රතික්රියාශීලතාවක් දක්වන අවර්ණ, ගන්ධයක් නොමැති, ඒක පරමාණුක අණුවලින් යුක්ත වූ සමාන ගුණ ඇති රසායනික මූලද්රව්ය කාණ්ඩයක් වේ. ස්වභාවයේ පවතින ස්වභාවයේ පවතින උච්ච වායු සය වනුයේ හීලියම්(He), නියෝන්(Ne), ආගන්(Ar), ක්රිප්ටෝන්(Kr), සෙනෝන්(Xe) සහ විකිරණශීල රෙඩෝන්(Rn) වේ.
ආවර්තිතා වගුවේ පළමු ආවර්ත සය සඳහා උච්ච වායු යනු නිශ්චිතවම 18 වන කාණ්ඩයේ සාමාජිකයන්ය. සාපේකෂීය බලපෑම් හේතුවෙන් 18 වන කාණ්ඩයේ මූලද්රව්යයක් වන යුනුනෝක්ටියම් වෙනුවට 14 වන කාණ්ඩයේ මූලද්රව්යයක් වන ෆ්ලෝරෝවියම් උච්ච වායු වලට අදාළ ගුණ පෙන්වයි. පරමාණුක ව්යුහය තුළ නවතම සිද්ධාන්ත වලට අනුව උච්ච වායු ගුණ ඉතා හොඳින් විස්තර කළ හැකි වේ. ඒවායේ සංයුජතා ඉලෙක්ට්රොණ සහිත බාහිර කවච "සම්පූර්ණ" වී පවතින බව සැළකෙයි. මේ නිසා රසායනික ප්රතික්රියා සඳහා අඩු ප්රවණතාවක් දක්වන අතර පිළියෙල කළ හැකි උච්ච වායු සංඛ්යාව සාපේක්ෂව කුඩා ප්රමාණයක් වේ. උච්ච වායූන්හි ද්රවාංක හා තාපාංක එකිනෙකට සමීප වන අතර 10 °C (18 °F)කට වඩා අඩු ප්රමාණයකින් එකිනෙකට වෙනස් වේ. එනම් ඒව කුඩා උෂ්ණත්ව පරාසයකින් ඉහළ දැමූ වීට ද්රව බවට පත් වේ
හීලියම් සාමාන්යයෙන් ස්වභාවික වායූන් ට අයත් නොවන අතර රෙඩෝන් සාමාන්යයෙන්, ද්රාවිත රේඩියම් සංයෝගවල විකිරණශීල ක්ෂය වීම හේතුවෙන් වෙන්ව පවතියි. උච්ච වායු යොදා ගන්නා කාර්මික යෙදීම් වශයෙන් ආලෝකකරණ කටයුතු, පෑස්සීම් කටයුතු සහ අභ්යවකාශ ගවේෂණ හැඳින්විය හැක. මීටර 55ට(අඩි 180) වඩා වැඩි මුහුදේදී කිමිදුම් කරුවන් විසින් ශ්වසනය සදහා හීලියම් සහ ඔක්සිජන් අඩංගු වායුවක් සුලබ ලෙස යොදා ගනු ලබයි. එමගින් කිමිදුම්කරුවන් ඔක්සිජන් ධූලකරක්තිය මගින් මුදවා ගැනීම, අධි පීඩන ඔක්සිජන්වල මාරාන්තික බලපෑමෙන් ආරක්ෂා කර ගැනීම, නයිට්ට්රජන් මාදකත්වය සහ මෙම ආංශික පීඩන පර්යන්තයෙන් එපිට පවතින වාතයේ ඇති නයිට්ට්රජන්වල උමතු කරවනසුළු මාදක බලපෑමෙන් රැක ගැනීම ආදිය අපේක්ෂා කෙරේ. හයිඩ්රජන්වල ගිනිගන්නාසුළු බව පැහැදිලි වීමෙන් පසුව බැලූන සහ කුඩා අහස් නැව් තැනීමේදී හයිඩ්රජන් වෙනුවට හීලියම් යොදා ගැනිණ.
ඉතිහාසය
[සංස්කරණය]උච්ච වායු සඳහා ඉංග්රීසි නාමය වන නෝබල් ගෑස් යන පදය ග්රීක භාෂාව තුළනාම පදයක් වන අතර ඊඩ්ල්ගාස් යන්නෙන් පරිවර්තනය වූ එකක් වේ. එය ප්රථම වරට 1898 දී හ්යුගෝ අර්ඩ්මාන්[1] විසින් මෙම වායු ගෝල වල පවතින අතිශය පහත් මට්ටමේ ප්රතික්රියාශීලතාව හැඟවීම සඳහා භාවිතා කරන ලදී. මෙම නම අඩු ප්රතික්රියාශීලතාවයකින් යුතු "උච්ච් ලෝහ" යන අර්ථයට සමාකාර වේ. උච්ච වායු නිෂ්ක්රීය වායු ලෙසද හඳුන්වන නමුත් පසුව හඳුනාගත් බොහෝමයක් උච්ච වායු සංයෝග එම අදහසට විරුද්ධ ලෙස ක්රියා කරයි. විරල වායු යනු ඊට භාවිතා වන තවත් පදයකි. නමුත් පෘථීවි වායුගෝලය[2] තුළ සැලකිය යුතු තරම් කොටසක (පරිමාව අනුව 0.94%, ස්කන්ධය අනුව 1.3%) අඩංගු වන නිසා එම යෙදුම ද නිවැරදි නොවේ.
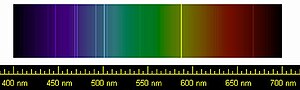
පියරේ ජැන්සෙන් සහ ජෝසප් නෝමන් ලෝක්යර් විසින් 1868 අගෝස්තු 18 වන දින නව මූලද්රව්යයක් සොයා ගන්නා ලදී. සූර්යාගේ වර්ණගෝලය නිරීක්ෂණය කරමින් සිටියදී සොයා ගැනුණු මෙම මූලද්රව්යයට ග්රීක භාෂාවෙන් සූර්යයා හදුන්වන ලබන ඉලියස් හෝ හීලියස් [3] යන්න අනුව එය 'හීලියම්' ලෙස නම් කරන ලදී. එකල්හි හීලියම් සඳහා කිසිදු පර්යේෂණයක් කිරීමට අපොහොසත් වූ අතර පසුකාලීනව එය උච්ච වායුවක් ලෙස හඳුනා ගැනිණ. ඔව්න්ට පෙර 1784 වර්ෂයේදී ඉංග්රීසි ජාතික රසායනඥ සහ භෞතික විද්යාඥ හෙන්රි කැවෙන්ඩිෂ් විසින් වායුගෝලය තුළ එහි නයිට්ට්රජන් [4] වලට වඩා අඩු ප්රතික්රියාශීලතාවකින් යුතු ද්රව්යයක් කුඩා ප්රමනයකින් අන්තර්ගත වන බව සොයා ගැනිණ. ඉන් සියවසකට පසු ලෝඩ් රේලීග් විසින් එම වායුගෝලීය නයිට්ට්රජන් සාම්පලයේ ඝනත්වය, රසායනික ප්රතික්රියා මගින් නයිට්ට්රජන් ලබා දෙන ප්රතිඵලවලට වඩා වෙනස් බව සොයා ගන්නා ලදී. ලන්ඩන් විශ්වවිද්යාලය ස්කොට් ජාතික විද්යාඥ විලියම් රැම්සේගේ සොයාගැනීම්වලට අනුව, වායුගෝලීය නයිට්ට්රජන් වෙනත් වායුවක් සමඟ මිශ්රව පවතින බව ලෝඩ් රේලීග් විසින් අනුමාන කරන ලදී. මේ ඔස්සේ කරන ලද පරීක්ෂණවල ප්රතිඵලයක් ලෙස "ආගන්" නමැති නව මූලද්රව්යය සොයා ගන්නා ලදී. මේ අතරතුර ක්ලීවයිට් ඛණිජය රත්කිරීමේදී ප්රථම වරට හීලියම් වෙන්කරගැනීමට රැම්සේ සමත් විය. 1902 වර්ෂයේදී හීලියම් සහ ආගන් සඳහා වූ සාක්ෂි පිළිගැනීමෙන් පසුව දිමිත්රි මෙන්ඩලීෆ් විසින් එම උච්ච වායු ඔහුගේ මූලද්රව්ය පෙළගැස්මෙහි 0 කාණ්ඩයට එක් කරන ලදී. මෙය පසුකාලීනව අවර්තිතා වගුව නම් විණි.[5]
රැම්සේ ද්රව වාතය සංඝටකවලට වෙන් කිරීමසඳහා භාගික ආසවනය ක්රමය යොදා ගනිමින් මෙම වායු පිළිබඳ වැඩිදුර කරුණු සොයා බැලීය. 1898 දී ක්රිප්ටෝන්, සෙනෝන් සහ නියෝන් යන මූලද්රව්ය සොයා ගත් ඔහු පිළිවෙලින් (ක්රිප්ටෝස්, "සැඟවුණු"), (නියෝන්, "නව"), සහ (සෙනෝස්, "අමුත්තා") යන ග්රීක පද අනුව නම්කළේය. පිඩ්රිච් අර්න්ස්ට් ඩෝන්,[6] විසින් 1898 දී පළමු වරට සොයගැනුණු "රෙඩෝන් නිස්රාවය" ලෙස නම් කෙරුණු නමුත් 1904 දී එය සතු උච්ච වායු ලක්ෂණ හඳුනා ගන්නා තුරු එය උච්ච වායුවක් ලෙස නොසැලකිණි. 1904 වර්ෂයේදී රේලීග් සහ රැම්සේ වෙත උච්ච් වායු සොයා ගැනීම සම්බන්ධයෙන් රසායන විද්යාව සඳහා නොබෙල් ත්යාගය පිරිනමන ලදී ; [7]එවකට රාජකීය ස්වීඩ්න් ජාතික විද්යා ශාස්ත්රාලය සභාපති ජේ. ඊ සෙඩෙර්බ්ලොම් විසින් මෙසේ ප්රකාශ කරන ලදී," එකදු ගුණයක්වත් නිෂ්චිත ලෙස හන්දුනා ගැනීමට අපොහොසත් වූ මෙම නවතම මූලද්රව්ය කාණ්ඩයේ සොයාගැනීම, නිසගයෙන්ම විද්යාවේ ප්රගමනයට හේතුවන රසායන විද්යාවේ අද්විතීය සොයාගැනීමක් වේ.";[8]
උච්ච වායූන්ගේ සොයාගැනීම, පරමාණුක ව්යුහය පිළිබඳ සාමාන්ය අවබෝධයක් ලබා ගැනීම සඳහා උපකාරී විය. 1895 වර්ෂයේ රසායන විද්යාඥ හෙන්රි මොයිසන් වඩාත්ම විද්යුත්-ඍණ මූලද්රව්යයක් වන ෆ්ලුවොරීන් සහ ආගන් ප්රතික්රියා කරවීමට උත්සාහ දැරුවද එය නිෂ්ඵල විය. 20වන සියවසේ අග භාගය වන තුරු ආගන් සංයෝග සෑදීම සඳහා විද්යාඥයෝ අසමත් වූහ. නමුත් එම ප්රයත්න රසායන විද්යාවේ නව සිද්ධාන්ත ගොඩනැගීම සඳහා උපකාරී විණි. මෙම පර්යේෂණ අධ්යයනය කිරීම මගින් ඩෙන්මාර්ක් ජාතික භෞතික විද්යාඥ නීල්ස් බෝර් , පරමාණුවක ඉලෙක්ට්රෝන න්යෂ්ටිය වටා යන කවච වල පිළියෙල වී තිබෙන බවත් හීලියම් හැර අනිකුත් සියලුම උච්ච වායුවල බාහිරතම කවචයේ ඉලෙක්ට්රෝන අටක් පවතින බවත් 1913 වර්ෂයේ ප්රකාශයට පත් කළේය. 1916 දී ගිල්බර්ට් එන්. ලුවිස් අෂ්ඨක නියමය හඳුන්වා දුන්නේය. මෙම නියමයට අනුව බාහිරතම කවචය ඉලෙක්ට්රෝන අටකින් පිරී ඇති අවස්ථාව පරමාණුවක වඩාත්ම ස්ථායී අවස්ථාව වන අතර බාහිරතම කවචය සම්පූර්ණ කරගැනීම සඳහා තවදුරත් ඉලෙක්ට්රෝන අවශ්ය නොවනු ඇත. උච්ච වායුවල පවතින මෙම ගුණය හේතුවෙන් ඒවා අනෙකුත් මූලද්රව්ය සමඟ ප්රතික්රියා කිරීමට කැමැත්තක් නොදක්වයි.[9]
1962 වසරේ නීල්ස් බාර්ට්ලට් විසින් සෙනෝන් හෙක්සෆ්ලුවොරොප්ලැටිනේට්.[10] නමැති ප්රථම උච්ච වායු සංයෝගය සාදන ලදී. ඊට කෙටි කාලයකට පසු අනෙකුත් උච්ච වායූන්ගේ අනිකුත් සන්යෝග ද සොයා ගැනිණි. 1962 දී රෙඩෝන්හි, රෙඩෝන්ඩයිෆ්ලුවොරයිඩ[11] ද 1963 දී ක්රිප්ටෝන්හි, ක්රිප්ටෝන්ඩයිෆ්ලුවොරයිඩ[12] ද සොයා ගැනිණ. 40K (−233.2 °C; −387.7 °F) උෂ්ණත්වයේදී ආගන් ෆ්ලුවොරො හයිඩ්රයිඩ පිළියෙල කිරීමේදී ප්රථම වරට ස්ථායී සංයෝගයක් වාර්ථා ව්ය. [13]
1998 දෙසැම්බරයේ රුසියාවේ, බඩ්නාහි ඒකාබද්ධ ආයතනයේ විද්යාඥයෝ පරමාණුක අංකය114ක් වන ෆ්ලරෝවියම් නමැති මූලද්රව්යය නිපදවීමට ප්ලූටොනියම්(Pu), කැල්සියම්(Ca) සමඟ විවර්ෂණය කළහ. ආවර්තිතා වගුවෙ 114වන කාණ්ඩයේ සාමාජිකයෙක් වුව අසාමාන්ය ලෙස උච්ච වායු ලක්ෂණ පෙන්වන ප්රථම මූලද්රව්ය මෙය වන බව ප්රාරම්භක රසායන විද්යා පර්යේෂණ පෙන්වා දෙයි. 2006 ඔක්තෝබරයේ න්යෂ්ටික පර්යේෂණ පිළිබඳ පර්යේෂණ පිළිබඳ ඒකාබද්ධ ආයතනය සහ ලෝරන්ස් ලිව්මෝර් ජාතික පර්යේෂණාගාරය විද්යාඥයෝ කැලිෆෝනියම් සහ කැල්සියම් විවර්ෂණය කිරීමෙන් සංශ්ලේෂක වශයෙන් යුනුනෝක්ටියම් නිපදවීමට සමත් වූහ.[14]
භෞතික සහ පරමාණුක ගුණ
[සංස්කරණය]| ලක්ෂණය[7][15] | හීලියම් | නියෝන් | ආගන් | ක්රිප්ටෝන් | සෙනෝන් | රෙඩෝන් |
|---|---|---|---|---|---|---|
| ඝනත්වය (g/dm³) | 0.1786 | 0.9002 | 1.7818 | 3.708 | 5.851 | 9.97 |
| තාපාංකය (K) | 4.4 | 27.3 | 87.4 | 121.5 | 166.6 | 211.5 |
| ද්රවාංකය (K) | 0.95[16] | 24.7 | 83.6 | 115.8 | 161.7 | 202.2 |
| වාෂ්පීකරණ එන්තැල්පිය (kJ/mol) | 0.08 | 1.74 | 6.52 | 9.05 | 12.65 | 18.1 |
| ද්රාව්යතාව ඡලයේ 20 °C (cm3/kg) | 8.61 | 10.5 | 33.6 | 59.4 | 108.1 | 230 |
| පරමාණුක ක්රමාංකනය | 2 | 10 | 18 | 36 | 54 | 86 |
| පරමාණුක අරය (ගණනයෙන්) (pm) | 31 | 38 | 71 | 88 | 108 | 120 |
| අයණීකරණ ශක්තිය (kJ/mol) | 2372 | 2080 | 1520 | 1351 | 1170 | 1037 |
| ඇලන් විද්යුත්-ඍණතාව[17] | 4.16 | 4.79 | 3.24 | 2.97 | 2.58 | 2.60 |
උච්ච පරමාණුවලට ඇත්තේ දුබල අන්තර් පරමාණුක බල වේ. මේ හේතුවෙන් ඒවාට ඉතා පහළ ද්රවාංක සහ තාපාංක පවතියි. ඒවා සියල්ල සම්මත තත්ත්ව යටතේ ඒක පරමාණුක වායු වේ. මෙම කාණ්ඩයට අදාළ ඉහළ [[පරමාණුක ස්කන්ධයක් ඇති මූලද්රව්ය පවා ඝන තත්ත්වයේ නොව වායු තත්ත්වයේ පවතියි.[7] අනෙකුත් මූලද්රව්ය සමඟ සසඳන කල්හි හීලියම් සඳහා ආවේණික වූ ගුණ කිහිපයක්ම වේ. ද්රවාංක හා තාපාංක අනෙකුත් උච්ච වායූන්ට වඩා පහළ මට්ටමක වවතී. දුස්රාවීතාව ශූන්යවන එකම මූලද්රව්යය මෙය වේ. සම්මත තත්ත්ව යටතේ සිසිල් කිරීමෙන් ඝන බවට පත්කළ නොහැකි එකම මූලද්රව්යය ද මෙය වේ. එය ඝන බවට පත් කිරීමට 0.95K (සෙන්ටිග්රේඩ් අංශක සහ -272.200ක්, ෆැරන්හයිට් අංශක -457.960ක්) යන උෂ්ණත්වය යටතේ සම්මත වායුගෝල පීඩන 25ක පීඩනයක් සැපයිය යුතු වේ.[18] සෙනෝන් දක්වා උච්ච වායුවලට බහු ස්ථායී සමස්ථානික පවතියි. රෙඩෝන් සඳහා ස්ථායී සමස්ථානික නොමැත. එහි දීර්ඝතම ආයු කාලයක් ඇති සමස්ථානිකය වන 222Rnවලට දින 3.8ක අර්ධ-ජීව කාලයක් පවතින අතර එය අවසානයේ ලෙඩ් බවට ක්ෂය වේ.[7]

උච්ච වායු මූලද්රව්යවල ගුණ අනෙකුත් මූලද්රව්ය කාණ්ඩවල පරිදිම එක් ආවර්තයක සිට ක්රමානුකූලව වැඩි වේ. මෙහිදී ඉලෙක්ට්රෝන සංඛ්යාව ක්රමයෙන් ඉහළ නැගීම මීට හේතුවයි. පරමාණුක විශාලත්වය හේතු කිහිපයක් හා සබැඳිව පවතී. උදාහරණයක් ලෙස විශාල ප්රමාණයේ උච්ච වායුවල සංයුජතා ඉලෙක්ට්රෝන න්යෂ්ටියට වඩා ඈත්ව පිහිටීම න්යෂ්ටියෙන් වඩා වෙත තදින් ආකර්ෂණය කොට තබා ගැනීමේ හැකියාව අඩු හේතුවන්, පරමාණුක අරය වැඩි වීමත් සමඟම ඒවායේ අයණීකරණ විභවය අඩු වේ. ඕනෑම ආවර්තයක මූලද්රව්ය අතර ඉහළම අයණීකරණ විභවය පවතින්නේ උච්ච් වායූන්ටය. මෙමගින් ඒවායේ ඉලෙක්ට්රෝන වින්යාසයන්හි ස්ථායීතාව පිළිබිඹු කරන අතර එය උච්ච් වායුවල පහළ රසායනික ප්රතික්රියාශීලතාව සමඟ සම්බන්ධකම් දක්වයි. ඇතැම් විශාල උච්ච් වායුවල අයණීකරණ විභව අනික් මූලද්රව්ය සමඟ සැසඳිය හැකි වන තරම් කුඩා වේ.ඒ අනුව සෙනෝන්හි අයනීකරණ විභවය ඔක්සිජන් අණුව අයනීකරණ විභවයට සමාන වේ. මෙම කරුණ උපයෝගී කරගනිමින් බාර්ට්ලට් විසින් ඔක්සිජන් සමඟ ප්රතික්රියා කිරීමට තරම් සමත් ඔක්සිකාරකයක් වන ප්ලැටිනම් හෙක්සෆ්ලුවොරයිඩයොදාගනිමින් සෙනෝන් ඔක්සිකරණය කරන ලදී. උච්ච වායුවලට ඍණ විද්යුත් බන්ධුතාවක් පවතින බැවින් ඒවාට ස්ථායී ඇනායන සෑදීමේ හැකියාවක් නොමැත.[19]
උච්ච වායූන්ගේ මහේක්ෂ්ය භෞතික ගුණ ඒවායේ දුබල වැන්ඩවාල්ස් බල මගින් ලබා දේ. පරමාණුවල විශාලත්වය වැඩි වත්ම ධ්රැවණශීලතාව ඉහළ යාමේ සහ අයනීකරණ විභවය පහළ යාමේ ප්රතිඵල ලෙස ක්රමානුකූල සමූහ නැඹුරුතාවන් දක්නට ලැබෙයි. 18 වන කාණ්ඩයේ පහළට යන විට පරමාණුක අරයද ඒසමඟම අන්තර්-පරමාණුක බල ද වැඩි වන අතර ඒ හේතුවෙන් ඒවායේ ද්රවාංක, තාපාංක, වාෂ්පීකරණ එන්තැල්පිය සහ ද්රාව්යතා ඉහළ නගිනු ඇත. ඒවායී ඝනත්වයේ ඉහළයාමට හේතුව පරමාණුක ස්ක්න්ධයේ වැඩි වීම වේ.[15]
උච්ච වායු සම්මත තත්ත්ව යටතේ බොහෝ දුරට පරිපූර්ණ වායු වේ. නමුත් පරිපූර්ණ වායු නියමවලින් ඒවා දක්වන අපගමන, අන්තර් අණුක අන්තර්ක්රියා අධ්යයනයට වැදගත් සාධක සපයයි. ලෙනාඩ්-ජෝන්ස් විභවය අන්තර් අණුක අන්තර්ක්රියා ආදර්ශනය කිරීමට බෙහෙවින් යොදා ගැනෙයි. අන්තර්-අණුක බල ප්රමූලධර්ම මගින් විස්තර කිරීමට යොදා ගන්නා ක්වොන්ටම් යාන්ත්ර විද්යා හන්ඳුන්වා දීමට සිදුකරන ලද ආගන් පිළිබඳ වූ දත්ත උපයෝගී කර ගනිමින් 1924 වර්ෂයේදී ජෝන් ලෙනාඩ්- ජෝන්ස් විසින් ලෙනාඩ් නෝන්ස් විභවය අපෝහනය කරන ලදී. උච්ච් වායු ගෝලාකාර, ඒක පරමාණුක ආකාරයෙන් පවතින අතර මේ හේතුවන් ඒවායේ පරමාණු අතර අන්තර්ක්රියා දිශාවකින් ස්වායක්ත වූ හෝ සමාවර්තනික වේ.
රසායනික ගුණ
[සංස්කරණය]
සම්මත තත්ත්ව යටතේ උච්ච වායු අවර්ණ, ගන්ධයක් නොමැති, ගිණි නොගන්නාසුළු ගුණ පෙන්වයි. ඒවා වරක් ආවර්තිතා වගුවේ 0 කාණ්ඩයේ මූලද්රව්ය ලෙස නම් වී තිබිණ. ඊට හේතුව වූයේ එවකට තිබූ විශ්වාසය අනුව ඒවා අනෙකුත් පරමාණු සමඟ සංයෝග සැදීමට අපොහොසත් සංයුජතාවය 0 වන මූලද්රව්ය ලෙස සැලකීමයි. කෙසේවෙතත් පසුකාලීනව ඇතැම් උච්ච වායු පිළිබඳ කරුණු හෙළි වීමත් සමඟ එම මතය බැහැර කෙරිණ.[20] අනෙකුත් කාණ්ඩ මෙන්ම උච්ච වායුද එහි ඉලෙක්ට්රෝන වින්යාසය රටා පෙන්වයි.
| Z | මූලද්රව්යය | ඉලෙක්ට්රෝන සංඛාව/කවචය |
|---|---|---|
| 2 | හීලියම් | 2 |
| 10 | නියෝන් | 2, 8 |
| 18 | ආගන් | 2, 8, 8 |
| 36 | ක්රිප්ටෝන් | 2, 8, 18, 8 |
| 54 | සෙනෝන් | 2, 8, 18, 18, 8 |
| 86 | රෙඩෝන් | 2, 8, 18, 32, 18, 8 |
මෙහිදී රසායනික හැසිරීම්වල නැඹුරුතාවන්හිදී බාහිරතම කවච විශේෂ වේ. උච්ච වායුවල සංයුජතා ඉලෙක්ට්රෝන කවච සම්පූර්ණ වී පවතියි. සංයුජතා ඉලෙක්ට්රෝන යනු පරමාණුවක බාහිරතම කවචයේ ඉලෙක්ට්රෝන වන ඉලෙක්ට්රෝන වන අතර සාමාන්යයෙන් රසායනික බන්ධන සෑදීමේදී සහභාගී වන එකම ඉලෙක්ට්රෝන වෙයි. සංයුජතා ඉලෙක්ට්රෝන කවච සම්පූර්ණ වූ පරමාණු අතිශය ස්ථායී තත්ත්වයේ පවතින අතර එම හේතුවෙන් ඒවා රසායනික බන්ධන සෑදීමට නැඹුරු නොවන අතර ඉලෙක්ට්රෝන පිටකිරීමට හෝ ලබා ගැනීමට කුඩා ප්රවණතාවයක් දක්වයි. කෙසේවෙතත් රෙඩෝන් වැනි විශාල උච්ච වායු හීලියම් වැනි සැහැල්ලු උච්ච වායු වලට වඩා ලිහිල් විද්යුත් චුම්භක බල මඟින් බැඳී පවතියි. මේ අනුව විශාල උච්ච වායුවල බාහිර ඉලෙක්ට්රෝන ඉවත් කිරීම වඩා පහසු වේ.
උච්ච වායු අංකනය
[සංස්කරණය]සම්පූර්ණව පවතින කවච හේතුවන් උච්ච වායු අංකනය සැකසීමේදී ඉලෙක්ට්රෝන වින්යාස අංකනය ද සම්බන්ධ කර ගත හැක. මේ සඳහා දී ඇති ගැටලුව තුළ හඳුනාගත හැකි ආසන්නතම උච්ච වායුව පළමුවෙන් සටහන් කරන අතර ඉන්පසුව එතැන් පටන් වන ඉලෙක්ට්රෝන වින්යාස සටහන් කෙරෙයි. උදාහරණයක් ලෙස කාබන්හි ඉලෙක්ට්රෝන වින්යාසය 1s22s22p2 වන අතර එහි උච්ච වායු අංකනය [He]2s22p2 වේ. මෙම අංකනය මූලද්රව්ය හඳුනාගැනීම පහසු කරවන අතර පරමාණුක කාක්ෂිකයන්හි සම්පූරණ අංකනයට වඩා කෙටි ආකාරයක් වේ.[21]
සංයෝග
[සංස්කරණය]
උච්ච වායු පෙන්වනුයේ අතිශය පහළ රසායනික ප්රතික්රියාශීලතාවයකි. මේ හේතුවෙන් සාපේක්ෂ්ව කුඩා ප්රමණයක උච්ච වායු සංයෝග ප්රමාණයක් පමණක් පවතියි. හීලියම් සහ නියොන් රසායනික බන්ධන සෑදීමෙහි යෙදී සිටින උදාසීන සංයෝග නිර්මාණය නොවන (ඒ නමුත් සිද්ධාන්තමය වශයෙන් හීලියම් සදන සංයෝග කිහිපයක් පිළිබඳ සාක්ෂි පවතී) සෙනෝන්, ක්රිප්ටෝන් සහ ආගන් සුළු ප්රතික්රියාශීලතා දක්වයි.[22] මේවායේ ප්රතික්රියාශීලතා Ne < He < Ar < Kr < Xe < Rn ආකාර ගනියි.
විශාල උච්ච වායුවලට ෆ්ලුවොරීන් සහ ඔක්සිජන් සමඟ සංයෝග සෑදීමේ හැකියාව ඇති බව 1933 වර්ෂයේදී ලිනස් පෝලිං අනාවැකි පළ කළේය. ක්රිප්ටෝන් හෙක්සෆ්ලුවොරයිඩ සහ සෙනෝන් හෙක්සෆ්ලුවොරයිඩ වල පැවැත්ම අනුමාන කළ ඔහු KrF6 අස්ථායී සංයෝගයක් ලෙස පැවතිය හැකි බව පෙන්වා දුන් අතර සෙනික් අම්ලය මගින් පර්සීනේට් ලවණ සෑදිය හැකි බව යෝජනා කළේය.[23][24] [25] මෙම අනාවැකි සාමාන්යයෙන් නිවැරදි බව දක්නට ලැබුණ ද XeF6 තාපගතිකමය සහ චාලක වශයෙන් අස්ථායී බැව් වර්තමානයේ සලකනු ලැබේ.
උච්ච වායු සාදන සංයෝග අතරින් සෙනෝන් සංයෝග වඩාත් ම විවිධාකාර වේ.[26] ඒවා බොහෝමයක් සෙනෝන්වල ඔක්සිකරණ අංක +2, +4,+6 හෝ +8 වන අතර ෆ්ලුවොරීන්, ඔක්සිජන් වැනි ඉහළ විද්යුත්- ඍණ පරමාණු හා බැඳී පවතී. ඊට උදාහරණ ලෙස සෙනෝන් ඩයිෆ්ලුවොරයිඩ XeF2, සෙනෝන් ටෙට්රාෆ්ලුවොරයිඩ් XeF4, සෙනෝන් හෙක්සලුවොරයිඩ් XeF6 සහ සෝඩියම් පර්සීනේට් Na4XeO6 දැක්විය හැක. මේ අතර වන සමහර සංයෝග රසායනික සංශ්ලේෂණයේදී ඔක්සිකාරකයක ලෙස යොදා ගැනෙයි. XeF2 විශේෂයෙන්ම වානිජමය වටිනාකමකින් යුතු වන අතර ෆ්ලුවොරිනීකරණ ද්රව්යයක් ලෙස යොඩා ගත හැකිය. 2007 වර්ෂයේ සිට අනෙකුත් මූලද්රව්ය හා බැඳී පවතින සෙනෝන් සංයෝග පන්සියයක් පමණ් හඳුනාගෙන ඇත.[22][27] මේ අතරට ඕගනෝසෙනෝන් සංයෝග (කාබන් හා බැඳුනු සෙනෝන් අඩංගු වූ) සෙනෝන් හා බැදුනු නයිට්රජන්, ක්ලෝරීන්, රත්රන් මර්කරි මෙන්ම සෙනෝන් හා බැඳුනු සෙනෝන් සංයෝග ද අඩංගු වේ.
ක්රිප්ටෝන් සෙනෝන්වලට වඩා ප්රතික්රියාශීලතාව අඩු නමුත් ඔක්සිකරණ අංකය +2 වූ ක්රිප්ටෝන් සංයෝග කිහිපයක්ම වාර්තා වේ. ඒ අතුරින් වඩාත්ම පහසුවෙන් හඳුනාගත හැකි වන්නේ ක්රිප්ටෝන් ඩයිෆ්ලුවොරයිඩ් ය. නයිට්රජන් සහ ඔක්සිජන් සමඟ ඒක බන්ධන සාදන ක්රිප්ටෝන් සංයෝග ද හ්ඳුනාගත හැක. ඒවා පිළිවෙලින් -60 °C (-76 °F) සහ -90 °C (130 °F) උෂ්ණත්ව යටතේ ස්ථායීව පවතියි.
ක්රිප්ටෝන් පරමාණු අනෙකුත් අලෝහ(හයිඩ්රජන්, ක්ලෝරීන්, කාබන්) සමඟ මෙන්ම ඇතැම් අන්තරික ලෝහ(කොපර්, සිල්වර්, රත්රන්) සමඟ ද බැඳී පවතින බව සොයාගෙන ඇත. නමුත් ඒවා දක්නට ලැබෙන්නේ පහත උෂ්ණත්ව මට්ටම් යටතේ උච්ච වායු මැට්ට්රිස් තුළ හෝ අති ධ්වනි උච්ච වාඅයු ජෙට් යානවල පමණි. මේ හා සමාන තත්ත්ව යටතේ ආගන්හි ප්රථම සංයෝග කිහිපය 2000 වර්ෂයේදී සොයා ගැනිණි. ඒවා අතර ආගන් ෆ්ලුවොරොහයිඩ්රයිඩ් සහ කොපෙර්,සිල්වර්, රත්රන් වඇනි අන්තරික ලෝහ සමඟ සාදන සංයෝග කිහිපයක්ද වේ. 2007 සිට හීලියම් හෝ නියෝන් සහසංයුජ බන්ධන අඩංගු කිසිදු උදාසීන අණුවක් හඳුනාගෙන නොමැත.
හීලියම්ද ඇතුළත්ව සියලුම උච්ච වායුවලට වාෂ්ප අවස්ථාවේ ස්ථායී අණුක අයන සෑදිය හැක. 1925දී උච්ච වායු අතර සරලම අණුක අයනය වන හීලියම් හයිඩ්රයිඩ් අණුක අයනය සොයා ගැනිණ. හයිඩ්රජන් සහ හීලියම් යන විශ්වයේ පවතින බහුලම මූලද්රව්ය දෙකෙන් මෙය තැනී ඇති නිසා, එය අන්තස්තාරීය මාධ්යය තුළ ස්වභාවිකවම හටගත හැකි බව විශ්වාස කෙරේ. කෙසේ නමුත් එවැන්නක් මෙතෙක් අණාවරණය වී නොමැත.
මෙම අයනවලට අමතරව උච්ච වායු වලින් සෑදුනු උදාසීන අස්ථායී සංයෝග රැසක් වේ. ඒවා අතර සැකැඹුණු අවස්ථාවේ පමණක් ස්ථායීව පවතින ArF, KrF වැනි සංයෝග පවතී. මේවා සමහරක් එක්සයිමර් ලේසර් තුළ යෙදීම්හිදී හමු වේ.
උච්ච වායු සහසංයුජ බන්ධන මෙන්ම සහසංයුජ නොවන බන්ධන ද කාබනික සහ අකාබනික ද්රව්යයන්ගේ ස්ඵටික දැලිස් කුහරවල සිරවුණු උච්ච වායු පරමාණුවලින් සමන්විත වූ විවරවත් ප්රථ්ම වරට විස්තර කරනු ලැබුවේ 1949 වසරේදීය. ඒවා පිළියෙළ කිරීමෙහි වූ වැදගත්ම සාධකය නම් උච්ච වායු පරමාණුවේ ප්රමාණය ඔක්සිකාරක ස්ඵටික දැලිසේ ප්රමාණයට ගැළපීමයි. උදාහරණයක් ලෙස හයිඩ්රොක්වීනෝන් සමඟ ආගන්, ක්රිප්ටෝන් සහ සෙනෝන් විවරවත් සෑදීම පෙන්වාදිය හැක. හීලියම් සහ නියෝන් ඒවායේ ඉතා කුඩාඅ පරමාණුක ප්රමාණ හේතුවන් හෝ ධ්රවණශීලතාවේ මඳ බව හේතුවෙන් එසේ නොපවතියි. නියෝන්, ආගන්, ක්රිප්ටෝන් සහ සෙනෝන් අයිස් තුළ සිරකරන ලද ක්ලැත්ත්රේට්(විවරවත්) හයිඩ්ඩ්රේට සාදයි.

එන්ඩොහීඩ්රල් ෆුලරන්ස් සංයෝග තුළ සැකසීමේ හැක්යාව උච්ච වායූන්ට පවතියි. මෙහිදී උච්ච වායු පරමාණුවක් ෆුලරන්ස් අණුවක් තුළ සිර කොට ඇත. කාබන් අණු 60කින් යුක්ත He ගෝලාකාර අණුව ඉහළ පීඩනයක් යටතේ He@C60වැනි (@ ලකුණින් ක්යැවෙන්නේ C60 තුළ He අඩංගු වුවද සහසංයුජ ලෙස බැඳී නොපවතින බවයි)සංයෝග සාදන බව 1933දී සොයා ගැනිණි. 2008 සිට හීලියම්, නියෝන්, ආගන්, ක්රිප්ටෝන්, සහ සෙනෝන් සාදන එන්ඩොහීඩ්රල් සන්කීර්ණ සොයාගෙන තිබේ. මෙවා උච්ච වායු පරමාණු තුළ න්යෂ්ටික චුම්භක සම්ප්රයුක්තතා අධ්යයනය කිරීම සඳා යොදා ගැනේ.

සෙනෝන් ඩයිෆ්ලුවොරයිඩ් වැනි උච්ච වායු සංයෝග අෂ්ටක නියමයට පටහැනි ලෙස පවතී. ඒවා තුළ ඇති බන්ධන 3-කේන්ද්රික-4-ඉලෙක්ට්රොන බන්ධන අකාරය ( 3-center-4-electron bond model)ලෙස හඳුන්වයි. ඒක රේඛීය පරමාණු තුනක් බන්ධනය වීම පිළිබඳව සලකන මෙම ආකෘතිය පලමු වරට 1951දී යෝජනා විණි. උදාහරණයක් ලෙස එක් එක් පරමාණුවේ p-කාක්ෂික වලින් සාදා ගත් අණුක කාක්ෂික 3කින් සැදුනු XeF2දැක්විය හැක. මෙය තුල Xeහි සම්පූර්ණ වූ p-කාක්ෂිකයක්ද, සෑම F පරමාණුවකම අර්ධ ලෙස පිරුනු p-කාක්ෂිකයක්කුත්, බන්ධන සෑදීමට සහභාගී නොවන සම්පූර්ණ වූ කාක්ෂිකයකුත්, එක් හිස් ප්රතිබන්ධනීය කාක්ෂිකයකුත් අඩංගු වේ. වඩාත්ම නියුතු පරමාණු කාක්ෂික පවතින්නේ අග්රස්ථ පරමාණු දෙකෙහිය. මෙය වඩාත්ම විද්යුත්-ඍණ ෆ්ලෝරීන්හි ආරෝපණ ස්ථානගතවීම පෙන්වයි.
වඩා විශාල උච්ච වායු වන ක්රිප්ටෝන් සහ සෙනෝන්හි රසායනය හොඳින් අනාවරණය වී ඇති අතර සැහැල්ලු උච්ච වායු වන හීලියම් සහ ආගන් පිලිබඳ සොයාගෙන ඇත්තේ ඉතා අල්ප ප්රමාණයකි.
හටගැනීම සහ නිෂ්පාදනය
[සංස්කරණය]විශ්වය තුළ උච්ච වායූන්ගේ සුලබත්වය, ඒවායේ පරමාණුක ක්රමාංකය ඉහළයත්ම අඩු වේ. හීලියම් යනු විශ්වයේ වඩාත්ම සුලභ මූලද්රව්යය වන අතර එහි ස්කන්ද අනුපාතය 24% වේ. විශ්වයේ පවතින හීලියම් වලින් බොහෝ ප්රමාණයක් විශ්වයේ මහා පිපුරුමේදී() හට ගත් ඒවා වේ. නමුත් තාරකා නියුක්ලියක විශ්ලේෂණයේඩී හීලියම් සංයෝජනය වීමත් (සහ විශාල පරමාණුවල ඇල්ෆා ක්ෂය වීමත්)හේතුවෙන් හීලියම් සංයුතිය ඍජු ලෙස වැඩි වෙමින් පවතී. පෘථිවියේ සුලබතා සඳහා විවිධාකාර නැඹුරු වීම් පවතී. උදාහරණයක් ලෙස හීලියම් යනු වායුගෝලයේ වඩාත් සුලබ තෙවන උච්ච වායුව පමණක් වේ.මෙයට හේතුව නම් කුඩා පරමාණුක ස්කන්ධය නිසා පෘථිවි ගුරුත්වාකර්ෂණ ක්ෂේත්රයේ නොපැවතීම හේතුවෙන් කිසිදු ප්රාරම්භක හීලියම් පරමාණුවක් නොපැවතීමය. පෘථිවි පෘෂ්ඨයේ පවතින යුරේනියම් සහ තෝරියම් වැනි මූලද්රව්යවල ඇල්ෆා ක්ෂය වීමෙන් පෘථිවියේ හීලියම් හටගන්නා අතර ස්වභාවික වායු නිධි තුළ රැස් වීමට නැඹුරුතාවක් දක්වයි. ආගන්හි සුලබතාව පොටෑසියම්-40 බීටා ක්ෂය වීමේදී හේතුවෙන් ඉහළ යයි. මෙහිඩී සෑදෙනුයේ ආගන්-40 වන අතර එය සෞරග්රහ මණ්ඩලයේ විරල වනු වනුවට ආගන්හි සුලබතම සමස්ථානිකය වේ.මෙම ක්රියාවලිය පොටෑසියම්-ආගන් කාලනිර්ණ ක්රමය නම් වේ. සෙනෝන් සඳහා අනපේක්ෂිත පහළ මට්ටමේ සුලබතාවක් පවතියි. මෙය "සෙනෝන් හිඟ වීමේ ගැටලුව"(missing xenon problem) නම් වේ. එක් සිද්ධාන්තයකට අනුව හිඟ වූ සෙනෝන් පෘථිවි පෘෂ්ටය තුලවන ඛනිජ තුළ සිර වී පවතින බව කියැවේ. සෙනෝන් ඩයොක්සයිඩ සොයා ගැනීමෙන් පසු කරන ලද සමීක්ෂණයකින් ක්වාට්ස් තුළ වන Si සඳහා Ar ආදේශ කර ගත හැකිබව පෙන්වයි. රේඩියම්හි ඇල්ෆා ක්ෂය වීමෙන් ශිලාගෝලය තුළ පවතින රෙඩෝන් සෑදෙයි. ඒවාට තම සංස්ථාපනයේ සිට පැළුම් හරහා ඇතුළට කාන්දු විය හැකි අතර හොඳින් වාතාශ්රය නොවූ තැන්හි රැඳෙනු ඇත. රෙඩෝහි ඉහළ විකිරණශීලතාව හේතුවෙන් එය විශේෂයෙන්ම සෞඛ්යයට අහිතකර වේ. මේ හේතුවෙන් ඇමරිකාවේ පමණක් වසරකට 21,000 පෙනහලු පිළිකා වාර්තා වේ.
| සුලභතාව | හීලියම් | [නියෝන් | ආගන් | ක්රිප්ටෝන් | සෙනෝන් | රෙඩෝන් |
|---|---|---|---|---|---|---|
| සෞරග්රහ මණ්ඩලය (සෑම සිලිකන් පරමාණුවක් සඳහාම)[28] | 2343 | 2.148 | 0.1025 | 5.515 × 10−5 | 5.391 × 10−6 | – |
| පෘථීවි වායුගෝලය (පරිමා අනුපාතය ppmවලින්)[29] | 5.20 | 18.20 | 9340.00 | 1.10 | 0.09 | (0.06–18) × 10−19[30] |
| ආග්නේය පාෂාණ (ස්කන්ධ අනුපාතය ppm වලින්)[15] | 3 × 10−3 | 7 × 10−5 | 4 × 10−2 | – | – | 1.7 × 10−10 |
| වායුව | 2004 වටිනාකම (USD/m3)[31] |
|---|---|
| හීලියම් (කාර්මික මටිටමේදි ) | 4.20–4.90 |
| හීලියම් (පර්යේෂණාගාර මටිටමේදි) | 22.30–44.90 |
| ආගන් | 2.70–8.50 |
| නියෝන් | 60–120 |
| ක්රිප්ටෝන් | 400–500 |
| සෙනෝන් | 4000–5000 |
නියෝන්, ආගන්, ක්රිප්ටෝන් සහ සෙනෝන් වායු ද්රවීකරණ ක්රම මගින් ලබා ගන්නේ. මෙහිදී එම මූලද්රව්ය ද්රව අවස්ථාවට පරිවර්ථනය කර භාගික ආසවනය මගින් ද්රව මිශ්රනය කොටස් වලට වෙන් කර ගනු ලැබේ.උච්ච වායු පිළිබඳ නොබෙල් ත්යාග ඒවායේ ස්වභාවික සුලභතාවය, එනම් ආගන් වඩාත්ම ලාබදායී සහ සෙනෝන් වඩාත්ම මිල අධික යන්න විශේෂයෙන් සලකනු ලබයි. උදාහරණයක් ලෙස දකුණු පස වන එක්සත් ජනපදයේ එක් එක් වායුවේ පර්යේෂණාගාර ප්රමාණයට වූ ත්යාග ලැයිස්තුගත කරයි.
යෙදීම්
[සංස්කරණය]උච්ච වායුවලට ඉතා පහල ද්රවාංක සහ තාපාංක පවතියි. එමනිසා ඒවා ශීතජනක ශීතකාරක සඳහා බාවිතා කෙරේ. විශෙෂයෙන්ම නටන උෂ්ණත්වය 4.2 K (−268.95 °C; −452.11 °F) වූ ද්රව හීලියම්, න්යෂ්ටික චුම්භක අනුධ්වනි මුර්තන සහ න්යෂ්ටික චුම්භක අනුධ්වනි සඳහා යොදා ගන්නා අධිසන්නායක චුම්භක සෑදීමට යොදා ගනු ලැබේ. ඩ්රව හීලියම් තරම් පහළ උෂ්ණත්වවල නොපැවතුන ද ද්රව නියෝන් ද ශීතජනක සඳහා යොදා ගනියි. මෙයට හේතුව නම්, එයට ද්රව හීලියම්වලට වඩා 40 ගුණයක සහ ද්රව හයිඩ්රජන්වලට වඩා තුන්ගුණයක ශීතජනක ධාරිතාවක් පැවතීම ය.
හීලියම්, ද්රව තුළ අඩු මට්ටමේ ද්රාව්යතාවයක් දැක්වීම හේතුවෙන්(විශේෂයෙන්ම ලිපිඩ තුළා හීලියම් ශ්වසන වායු සඳහා යොදා ගන්නා සංඝටකයක් වේ) ස්කුබා උපකරණ යොදා ගනිමින් කිමිදීමේදී වැනි(scuba diving) පීඩන සහිත තත්ත්ව තුළ රුධිරය සහ සිරුරේ පටක මගින් වායු අවශෝෂණය සිදු වේ. මෙම තත්ත්වය නයිට්රජන් නාකෝසිස්(nitrogen narcosis) නමැති නිර්වින්දන බලපෑම ඇති කිරීමට සමත් වේ. එහි පහත හෙලන ලද ද්රාව්යතාව හේතුවෙන් සෛල පටල තුළට අඩු හීලියම් ප්රමාණයක් ලබා ගනියි. හීලියම්, එහි පහත හෙලන ලද ද්රාව්යතාව හේතුවෙන් සෛල පටල තුළට අඩු හීලියම් ප්රමාණයක් ලබා ගනියි. හීලියම් ශ්වසන මිශ්රනවල කොටස් ට්රයිමික්ස් හෝ හිලියොක්ස් වැනි ප්රතිස්ථාපනය කිරීම්වලදී, ගැඹුරු ස්ථානවල වායුවේ නාකෝටික් බලපෑමේ පහත වැටීමක් අධ්යයනය කෙරෙයි. හීලියම්හි පහත ද්රාව්යතාව විසම්පීඩනය, කුදය වැනි රෝගී තත්ත්ව ප්රතිකාර කිරීමේදී උපකාරී වේ. ශරීරයේ පහත වැටුණු ද්රාවිත වායු ප්රමාණයෙන් හැඟවෙන්නේ පීඩන උද්දමනය පහත වැටීමේදී අඩු වායු බුබුලු ප්රමාණයක් හටගන්නා බවයි. තවත් උච්ච වායුවක් වන ආගන්, ස්කුබා කිමිදුම්වලට යොදා ගන්නා කිමිදුම් ඇඳුම් සඳහා සුළං පිරවීමේ වායුවක් ලෙස යොදා ගැනේ. හීලියම්, න්යෂ්ටික ප්රතික්රියකවලට යොදා ගන්නා න්යෂ්ටික ඉන්ධනවල පිරවුම් වායුවක් ලෙසද යොදා ගැනෙයි.
1937දී සිදු වූ හින්ඩන්බර්ග් විනාශයේ සිට කුඩා අහස් නැව් සහ බැලූන සඳහා හයිඩ්රජන් වෙනුවට හීලියම් එසැවුම් වායුවක් ලෙස යොදා ගැනුණි.
බොහෝ යෙදීම්හි, උච්ච වායු නිෂ්ක්රීය වාතාවරණයක් පෙන්වයි. නයිට්රජන් සඳහා සංවේදී, වායු-සංවේදී සංයෝග(air-sensitive compounds) සංයෝග සඳහා ආගන් යොදා ගනේ. අස්ථායී සංයෝග නිෂ්ක්රීය මැට්රිසයක් තුළ සිර කරගනිමින් අධ්යයනය සඳහා ඝන ආගන් යොදා ගැනෙයි.වායු වර්ණලේඛ ශිල්පයේ මාධ්යයක් ලෙස හීලියම් යොදා ගැනෙයි. තවද එය උෂ්ණත්වමානවල පිරවුම් වායුවක් ලෙස සහ ගයිගර් ගණක සහ බුබුලු කුටි ආදී විකිරණ මැනීමේ උපකරණවල යොදා ගැනෙයි. හීලියම් සහ ආගන් දෙකම පොදුවේ වෑල්ඩින් කටයුතු වලදී ආරක්ෂාව සඳහා සහ වෙනත් ලෝහ විද්යාත්මක ක්රියාවලි සඳහා යොදා ගන්න අතර අර්ධසන්නායක කර්මාන්තයේදී සිලිකන් නිපදවීමටද භාවිතා කරයි.
අඩු ප්රතික්රියාශීලතාව හේතුවෙන් උච්ච වායු සාමාන්යයෙන් ආලෝකකරණ කටයුතු සඳහා යොදා ගනියි. නයිට්රජන් සමඟ මිශ්රිත ආගන්, තාපදීප්ත ආලෝක බල්බ සඳහා යොදා ගැනෙයි. ඉහළ වර්ණ උෂ්ණත්ව සහිත ඉහළ ක්රියාකාරීත්වයකින් යුතු සහ ඉහළ ක්ෂමතාවකින් යුතු විදුලි බුබුලුවලට ක්රිප්ටෝන් යොදා ගැනෙයි. මෙයට හේතුව නම්, එය සූත්රිකාවේ වාෂ්පීකරණ අනුපාතය ආගන්වලට වඩා පහත හෙලීමය. විශෙෂ්යෙන්ම, කුඩා ප්රමාණවලින් අයඩීන් සහ බ්රෝමීන් සමඟ මිශ්රිත ක්රිප්ටෝන් අඩංගු හැලජන් ලාම්පු මේවා භාවිතා කරයි. "නියෝන් ආලෝකය" වැනි වායු විසර්ජන ලාම්පු තුළ උච්ච වායු විශිෂ්ට වර්ණ ගෙන දෙමින් දිදුළයි. මෙම ආලෝක නියෝන් පෙරටු කොටගෙන නම්වන නමුත් බොහෝවිට රතු-තැඹිළි වැනි පැහැයන් එකතු කරන අනෙකුත් වායු සහ ප්රකාශදවලින් සමන්විත වෙයි. සෙනෝන් පොදුවේ සෙනෝන් සෙනෝන් චාප ලාම්පු තුළ භාවිතා කෙරෙන අතර එයට හේතුව නම්, ඒවායේ දිවා එළියට සමාන සන්තත වර්ණාවලියයි. එහි යෙදීම් චිත්රපට සඳහා යොදා ගන්නා ප්රොජෙක්ටර සහ මෝටර් රථවල ප්රධාන පහන් තුළ දැකිය හැකි වේ.
උච්ච වායු එක්සයිමර් ලේසර් කිරණ(Excimer lasers) සඳහා යොදා ගැනේ. ඒවා අඩු ආයු කාලයක් සහිත එක්සයිමර් නමැති ඉලෙක්ට්රොනික වශයෙන් සැකැඹුණු අණු මත පදනම් වේ. මෙම එක්සයිමර් ලේසර් කිරණ Ar2, Kr2 හෝ Xe2වැනි ද්වි-පරමාණුක අණු හෝ බොහෝවිට උච්ච වායු සමඟ බැඳුනු හැලජනවන ArF, KrF, XeF හෝ XeCl ආදියෙන් නිර්මාණය වී ඇත. එක්සයිමර් ලේසර් කිරණ කාර්මික, වෛද්ය, විද්යාත්මක යෙදීම් ආදියට බොහෝ සෙයින් යොදා ගැනෙයි.
ඇතැම් උච්ච වායු වෛද්ය විද්යාවේදී ඍජු ලෙස යොදා ගැනෙයි. හීලියම් ඇතම් අවස්ථාවලදී ශ්වසන රෝගීන්ගේ ශ්වසනය පහසු කරවීම සඳහා යොදා ගැනෙයි. සෙනෝන් නිර්වින්දකයක් ලෙස භාවිතයට ගැනෙයි. එය ලිපිඩ තුළ වන ඉහළ ද්රාව්යතාව(නයිට්රස් ඔක්සයිඩ්වලට වඩා ප්රබල ලෙසා සහ පහසුවෙන් ශරීරයෙන් බැහැරවෙමින් ඉක්මන් සුවයක් ලබා දීම ඊට හේතු වේ. සෙනෝන් හයිපර්පෝලරයිස්ඩ් MRI( hyperpolarized MRI) මගින් පෙනාළුවල වෛද්ය මුර්තන ලබා ගැනීමේදී භාවිතයට ගැනේ. ඉහළ විකිරණශීලතාවකින් යුතු ඉතා කුඩා ප්රමාණයකින් පවතින රෙඩෝන් විකිරණ චිකිත්සාවේදී භාවිතයට ගැනෙයි.
විසර්ජිත වර්ණ
[සංස්කරණය]
|

|

|

|

|

|

|

|

|

|

|

|

|

|

|
| හීලියම් | නියෝන් | ආගන් ("ආගන්" අනුරූපයේ යම් Hg ප්රමාණයක් අඩංගු වේ.) |
ක්රිප්ටෝන් | සෙනෝන් |
විසර්ජිත ආලෝකයේ වර්ණය කරුණු කිහිපයක් මත් පදනම් වේ.
- විසර්ජිත පරාමිතීන්( පවතින ඝනත්වය සහ විද්යුත් ක්ෂේත්රය, උෂ්ණත්වය ආදී)- විසර්ජිත් වර්ණ වෙනස්වීම් ඉහළ පෙළෙහි දැකෙවෙන බව සලකන්න;
- වායු සංශුද්ධතාව(නිශ්චිත වායුවල කුඩා කොටසකට පමණක් වර්ණය සඳහා බලපෑම් කිරීමේ හැකියාව පවතියි.);
- විසර්ජන නළය ආවරණයට ගන්නා ලෝහ-– පහත පෙළ නළ පාරජම්බූල කිරණ ආදියෙන් ආවරණය සඳහා ගනකම් ගෘහස්ථ වීදුරුවලින් නිමවා ඇත.
මේවාත් බලන්න
[සංස්කරණය]- උච්ච වායු(දත්ත පිටුව), භෞතික ගුණ සම්බන්ධ විස්තෘත වගු සඳහා.
- උච්ච ලෝහ, විඛාදනයට හෝ ඔක්සිකරණයට ප්රතිරෝධී ලෝහ සඳහා.
- නිෂ්ක්රීය වායු, සාමාන්ය තත්ත්ව යටතේ ප්රතික්රියකශීලී නොවන ඕනෑම වායුවක් සඳහා.
- කාර්මික වායු
- නියුට්රෝනියම්
සටහන්
[සංස්කරණය]- ^ Renouf, Edward (1901). "Noble gases". Science. 13 (320): 268–270. Bibcode:1901Sci....13..268R. doi:10.1126/science.13.320.268.
- ^ "argon". Encyclopædia Britannica. 2008. http://www.britannica.com/eb/article-9009382/argon.
- ^ Oxford English Dictionary (1989), s.v. "helium". Retrieved December 16, 2006, from Oxford English Dictionary Online. Also, from quotation there: Thomson, W. (1872). Rep. Brit. Assoc. xcix: "Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium."
- ^ Ojima 2002, p. 1
- ^ Mendeleev 1903, p. 497
- ^ Partington, J. R. (1957). "Discovery of Radon". Nature. 179 (4566): 912. Bibcode:1957Natur.179..912P. doi:10.1038/179912a0.
- ^ a b c d "Noble Gas". Encyclopædia Britannica. 2008. http://www.britannica.com/eb/article-9110613/noble-gas.
- ^ උපුටාදැක්වීම් දෝෂය: අනීතික
<ref>ටැගය;nobelchemනමැති ආශ්රේයන් සඳහා කිසිදු පෙළක් සපයා නොතිබුණි - ^ Gillespie, R. J.; Robinson, E. A. (2007). "Gilbert N. Lewis and the chemical bond: the electron pair and the octet rule from 1916 to the present day". J Comput Chem. 28 (1): 87–97. doi:10.1002/jcc.20545. PMID 17109437.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Bartlett, N. (1962). "Xenon hexafluoroplatinate Xe+[PtF6]–". Proceedings of the Chemical Society (6): 218. doi:10.1039/PS9620000197.
- ^ Fields, Paul R.; Stein, Lawrence; Zirin, Moshe H. (1962). "Radon Fluoride". Journal of the American Chemical Society. 84 (21): 4164–4165. doi:10.1021/ja00880a048.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Grosse, A. V.; Kirschenbaum, A. D.; Streng, A. G.; Streng, L. V. (1963). "Krypton Tetrafluoride: Preparation and Some Properties". Science. 139 (3559): 1047–1048. Bibcode:1963Sci...139.1047G. doi:10.1126/science.139.3559.1047. PMID 17812982.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku (2000). "A stable argon compound". Nature. 406 (6798): 874–876. doi:10.1038/35022551. PMID 10972285.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Sagaidak, R.; Shirokovsky, I.; Tsyganov, Yu.; Voinov, A. (2006). "Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm + 48Ca fusion reactions". Physical Review C. 74 (4): 44602. Bibcode:2006PhRvC..74d4602O. doi:10.1103/PhysRevC.74.044602.
- ^ a b c Greenwood 1997, p. 891
- ^ Under pressure of 25 bar
- ^ Allen, Leland C. (1989). "Electronegativity is the average one-electron energy of the valence-shell electrons in ground-state free atoms". Journal of the American Chemical Society. 111: 9003. doi:10.1021/ja00207a003.
- ^ "Solid Helium". University of Alberta. සම්ප්රවේශය 2008-06-22.
- ^ Wheeler, John C. (1997). "Electron Affinities of the Alkaline Earth Metals and the Sign Convention for Electron Affinity". Journal of Chemical Education. 74: 123–127. Bibcode:1997JChEd..74..123W. doi:10.1021/ed074p123.; Kalcher, Josef; Sax, Alexander F. (1994). "Gas Phase Stabilities of Small Anions: Theory and Experiment in Cooperation". Chemical Reviews. 94: 2291–2318. doi:10.1021/cr00032a004.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Mott, N. F. (1955). "John Edward Lennard-Jones. 1894–1954". Biographical Memoirs of Fellows of the Royal Society. 1: 175–184. doi:10.1098/rsbm.1955.0013.
- ^ CliffsNotes 2007, p. 15
- ^ a b Grochala, Wojciech (2007). "Atypical compounds of gases, which have been called noble". Chemical Society Reviews. 36 (10): 1632–1655. doi:10.1039/b702109g. PMID 17721587.
- ^ Pauling, Linus (1933). "The Formulas of Antimonic Acid and the Antimonates". Journal of the American Chemical Society. 55 (5): 1895–1900. doi:10.1021/ja01332a016.
- ^ Holloway 1968
- ^ Seppelt, Konrad (1979). "Recent developments in the Chemistry of Some Electronegative Elements". Accounts of Chemical Research. 12 (6): 211–216. doi:10.1021/ar50138a004.
- ^ Moody, G. J. (1974). "A Decade of Xenon Chemistry". Journal of Chemical Education. 51 (10): 628–630. Bibcode:1974JChEd..51..628M. doi:10.1021/ed051p628. සම්ප්රවේශය 2007-10-16.
- ^ Harding 2002, pp. 90–99
- ^
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ^ "The Atmosphere". National Weather Service. සම්ප්රවේශය 2008-06-01.
- ^ උපුටාදැක්වීම් දෝෂය: අනීතික
<ref>ටැගය;ullmannනමැති ආශ්රේයන් සඳහා කිසිදු පෙළක් සපයා නොතිබුණි - ^ Hwang, Shuen-Chen; Lein, Robert D.; Morgan, Daniel A. (2005). "Noble Gases". Kirk Othmer Encyclopedia of Chemical Technology. Wiley. pp. 343–383. doi:10.1002/0471238961.0701190508230114.a01.
{{cite book}}: CS1 maint: multiple names: authors list (link)
යොමුව
[සංස්කරණය]- Bennett, Peter B. (1998). The Physiology and Medicine of Diving. SPCK Publishing. ISBN 0-7020-2410-4.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help)CS1 maint: ref duplicates default (link) - Bobrow Test Preparation Services (2007-12-05). CliffsAP Chemistry. CliffsNotes. ISBN 0-470-13500-X.
- Greenwood, N. N. (1997). Chemistry of the Elements (2nd ed.). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help)CS1 maint: ref duplicates default (link) - Harding, Charlie J. (2002). Elements of the P Block. Royal Society of Chemistry. ISBN 0-85404-690-9.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help)CS1 maint: ref duplicates default (link) - Holloway, John H. (1968). Noble-Gas Chemistry. London: Methuen Publishing. ISBN 0-412-21100-9.
{{cite book}}: CS1 maint: ref duplicates default (link) - Mendeleev, D. (1902–1903). Osnovy Khimii (The Principles of Chemistry) (Russian බසින්) (7th ed.).
{{cite book}}: CS1 maint: unrecognized language (link) - Ojima, Minoru (2002). Noble Gas Geochemistry. Cambridge University Press. ISBN 0-521-80366-7.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help)CS1 maint: ref duplicates default (link) - Weinhold, F. (2005). Valency and bonding. Cambridge University Press. ISBN 0-521-83128-8.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help)CS1 maint: ref duplicates default (link) - Scerri, Eric R. (2007). The Periodic Table, Its Story and Its Significance. Oxford University Press. ISBN 0-19-530573-6.
{{cite book}}: CS1 maint: ref duplicates default (link)
| ආවර්තිතා වගුව | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
