පරමාණු
| හීලියම් පරමාණුව | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| න්යෂ්ටිය (රෝස) සහ ඉලෙක්ට්රෝන වලාව ව්යාප්තිය(කළු) ලෙසින් විචිත්රවත් ලෙසින් විස්තර කෙරෙන හීලියම් පරමාණුවෙහි නිරූපණයක්. හීලියම්-4 හි න්යෂ්ටිය (උඩු දකුණු) සත්ය ලෙසින් ගෝලීය සමමමිතික වන අතර ඉලෙක්ට්රෝන වලාවට කිට්ටුවෙන් සමානතාවයක් දක්වන වමුදු, වඩාත් සංකීර්ණ න්යෂ්ටීන් සඳහා සැම විටම එය එසේ නොවේ. කළු පටිය ඇංස්ට්රම් එකකි (10−10 මී හෝ 100 පිමී). | ||||||||
| වර්ගීකරණය | ||||||||
| ||||||||
| ගුණාංග | ||||||||
|
පදාර්ථයෙහි මූලික ඒකකය වන පරමාණුව ඝන, මධ්යගත න්යෂ්ටියකින් හා එය වටකරගත් සෘණ ආරෝපිත ඉලෙක්ට්රෝන අඩංගු වලාවකින් සමන්විත වෙයි. පරමාණුක න්යෂ්ටිය සමන්විත වන්නේ ධන ආරෝපිත ප්රෝටෝන සහ විද්යුත් වශයෙන් උදාසීන නියුට්රෝන (හයිඩ්රජන්-1 විෂයයෙහි පමණක් මෙය වෙනස් වන්නේ එය නියුට්රෝන විරහිත එකම ස්ථායි නියුක්ලයිඩය වන බැවිනි) වල මිශ්රණයකිනි. පරමාණුවක ඉලෙක්ට්රෝන එහි න්යෂ්ටියට බන්ධනය වන්නේ විද්යුත් චුම්බක බල අනුසාරයෙනි. එලෙසින්ම, පරමාණු සමුහයක් එකිනෙක වෙත බැඳී පැවතීමෙන් අණුවක් නිමැවිය හැක. ප්රෝටෝන හා ඉලෙක්ට්රෝන සමාන සංඛ්යාවක් සහිත පරමාණුවක් විද්යුත් වශයෙන් උදාසීන වන අතර, එසේ නොවන අවස්ථාවන්හීදී එය ධන ආරෝපණයක් (ඉලෙක්ට්රෝන ඌනතාව) හෝ සෘණ ආරෝපණයක් (ඉලෙක්ට්රෝන අතිරික්තය) හෝ සහිත අතර එය අයනයක් වෙයි. පරමාණුවක් වර්ගීකරණය කෙරෙනුයේ එහි න්යෂ්ටියෙහි සමන්විත ප්රෝටෝන සහ නියුට්රෝන සංඛ්යාව අනුවය: ප්රෝටෝන සංඛ්යාව විසින් නිශ්චය කෙරෙනුයේ රසායනික මූලද්රව්යය වන අතර, නියුට්රෝන සංඛ්යාව විසින් නිශ්චය කෙරෙනුයේ මූලද්රව්යයෙහි සමස්ථානිකය වෙයි.[1]
පරමාණුව සඳහා ඉංග්රීසියෙන් ව්යවහාර වන ඇටම් යන පදය බිඳී ඇත්තේ, නො-කැපියහැකි, හෝ නො-බෙදියහැකි, එනම් තවදුරටත් බෙදිය නොහැකි යමක් යන අර්ථය දෙන, ග්රීක "ἄτομος"—ඇටමෝස් (α-, "නො-" + τέμνω – ටෙම්නො, "කැපිය හැකි"[2] වෙතින්) පදයෙනි.[3] පදාර්ථයෙහි නොබෙදිය හැකි කොටසක් ලෙසින් පරමාණුව පිළිබඳ සංකල්පය ප්රථමයෙන් යෝජනා කර ඇත්තේ පුරාතන ඉන්දීය සහ ග්රීක දර්ශනවාදීන් විසිනි. 17වන සහ 18වන සියවස් වලදී, රසායනඥයින් විසින් මෙම අදහස සඳහා භෞතික පදනමක් සැපයූයේ සමහරක් ද්රව්යයන් රසායනික ක්රම අනුසාරයෙන් තවදුරටත් කොටස් වලට බිඳ දැමිය නොහැකි බව පෙන්වීමෙනි. 19වන සියවසෙහි අග භාගයේදී සහ 20වන සියවසෙහි මුල් භාගයෙහිදී, භෞතිකඥයින් විසින් අනු-පරමාණුක සංරචක සහ පරමාණු වල අභ්යන්තර ව්යුහය සොයාගත් අතර, එනයින් 'පරමාණුවක්' බෙදිය හැකි බවට ආදර්ශනය කලහ. පරමාණුව සාර්ථක ලෙසින් නිරූපකරණය කරනු වස් ක්වොන්ටම් යාන්ත්ර විද්යාවෙහි මූල ධර්ම භාවිතා කෙරිණි.[4][5]
පරමාණු අතිශයින් කුඩා වස්තූන් වන අතර සමානුපාතික ලෙසින් ක්ෂුද්ර ස්කන්ධයන්ට හිමිකම් කියති. පරමාණු තනි තනිව නිරීක්ෂණය කල හැක්කේ පරිලෝකන උමං අන්වීක්ෂය වැනි විශේෂ උපකරණ භාවිතයෙන් පමණි. පරමාණුවක ස්කන්ධයෙන් 99.9% කට වඩා ඒකාග්රව ඇත්තේ න්යෂ්ටිය තුල වන අතර, [note 1] ප්රොටෝන හා නියුට්රෝන දළ වශයෙන් සමාන ස්කන්ධ සහිත වෙති. සෑම මූලද්රව්යයක්ම අවම වශයෙන් එක් සමස්ථානිකයක් හෝ සහිත වන අතර මෙම සමස්ථානිකයන්හී අස්ථායී න්යෂ්ටීන් විකිරණශීලී ක්ෂයවීමට භාජනය විය හැක. මෙය නිසා, න්යෂ්ටියක ප්රෝටෝන හා නියුට්රෝන සංඛ්යාව වෙනස්වීමට ලක් වන තත්වාන්තරණයට හේතු පාදක විය හැක.[6] පරමාණුවලට බන්ධනය වී පවතින ඉලෙක්ට්රෝන විසින්, ස්ථායී ශක්ති මට්ටම් හෝ, කාක්ෂික මාලාවක් සහිතව සිටින අතර, මට්ටම් අතර ශක්ති වෙනසට සමාන වූ ෆෝටෝන අවශෝෂණය හෝ විමෝචනය හෝ කිරීමෙන් එම මට්ටම් අතර සංක්රමණය විය හැක. ඉලෙක්ට්රෝන විසින් මූලද්රව්යයක රසායනික ගුණ පිළිබඳ බලපෑම් ඇති කරන අතර, පරමාණුවෙහි චුම්බක ගුණාංග කෙරෙහි දැඩි බලපෑමක් ඇති කරයි.
ඉතිහාසය
[සංස්කරණය]පදාර්ථය අභිමත පරිදි කුඩා කොටස්වලට වෙන් කළ නොහැකි කුඩා ඒකකවලින් සමන්විත වේය යන සංකල්පය සහස්රකයක් පමණ අතීතයේ පටන් පැවෙතෙන්නකි. නමුත් ආරම්භක අවදියේ දී මෙම සංකල්පයට පදනම් වූයේ පර්යේෂණ සහ ආනුභවික නිරීක්ෂණ වෙනුවට අමූර්ත දාර්ශනික හේතු දැක්වීම් වේ. කලින් කලට, සංස්කෘතියෙන් සංස්කෘතියට සහ ඉගෙනුම් සම්ප්රදායක් අතර පරමාණුවෙහි ස්වභාවය පිළිබඳව විවිධ දාර්ශනික මතයන් පැවති අතර බොහෝ විට මෙම මතයන් තුළ අධ්යාත්මික ලක්ෂණ ද අන්තර්ගත විය. කෙසේ නමුත් රසායන විද්යා ක්ෂේත්රයේ නව සොයා ගැනීම් ඉතා අලංකාර ලෙස විස්තර කිරීමට යොදා ගත හැකි වූ හෙයින් පරමාණුව පිළිබඳ සංකල්පය එය මුල්වරට ඉදිරිපත් වීමෙන් වසර දහස් ගණනකට පසු විද්යාඥයන් විසින් සිය ක්ෂේත්රයට ඈඳා ගන්නා ලදී.
පරමාණුව පිළිබඳ සංකල්පය සම්බන්ධ මුල්ම සඳහන් හමු වන්නේ ක්රි.පූ. 6 වැනි සියවසේ ආදි ඉන්දියාවෙනි. පරමාණු එක්වී වඩාත් සංකීර්ණ වස්තූන් නිර්මාණය වන ආකාරය පිළිබඳ (පළමුව යුගල් වශයෙන්, අනතුරුව යුගල් ත්රිත්ව වශයෙන්) විස්තරාත්මක මතවාද න්යාය සහ වෛශේෂිත සම්ප්රදායන් තුළ අන්තර්ගත විය. බටහිර ලෝකයේ මුල්වරට පරමාණු පිළිබඳ මත පළ වීම මින් ශතවර්ෂයක් ගත වත්ම ආරම්භ විය. මෙම මතයන් මුල්වරට ලුසිපස් විසින් ඉදිරිපත් කළ අතර ඔහුගේ ශිෂ්ය ඩිමොක්රිටස් ක්රමානුකූලව සකස් කළේය. ක්රි.පූ. 450 දී පමණ ඩිමොක්රීටස් විසින් “කැපිය නොහැකි”නැතහොත් “පදාර්ථය තවදුරටත් බෙදිය නොහැකි කුඩාම අංශුව” එනම් බෙදිය නොහැකි යන අරුත ඇති ඇටමෝස් (átomos) නම් පදය (ග්රීක බසින් ἄτομος) හඳුන්වා දෙන ලදී. මෙම ඉන්දියානු සහ ග්රීක සංකල්ප හුදු දර්ශනවාදී අදහස් මත පදනම් වූ ඒවා වුව ද, ඩිමොක්රීටස් විසින් පරමාණු සඳහා හඳුන්වාදුන් “ඇටමෝස්” යන පදය පොදුවේ විද්යාඥයන් විසින් භාවිතා කරති.
මුල් යුගයන්ගෙන් අනතුරුව රසායන විද්යාව දියුණුව ඇරඹෙන තෙක්ම පරමාණු පිළිබඳ වැඩි අවබෝධයක් නොවීය. 1661 වසරේදී ස්වභාව දාර්ශනික රොබට් බොයිල් සිය “The Sceptical Chymist” නම් ග්රන්ථය ඔස්සේ පදාර්ථය විවිධ සහ එකිනෙකට වෙනස් දේහාණු නැතහොත් පරමාණු මිශ්රණවලින් සමන්විත වේ යැයි මතයක් පළ කළේය. මෙය පදාර්ථය වාතය, පස, ගින්න සහ ජලය යන අංගවලින් සෑදී ඇති බවට තිබූ පැරණි මතයට එරෙහි විය. 1789 වසරේදී ප්රංශ වංශාධිපතියෙකු සහ විද්යාත්මක පර්යේෂකයෙකු වූ ඇන්ටොයින් ලැවෝෂියර් විසින් “මූලද්රව්යයක්” යන පදය රසායනික ක්රම මඟින් තවදුරටත් සරල කොටස්වලට බිඳිය නොහැකි මූලික ද්රව්යයක් ලෙස අර්ථ දැක්වීය.
1803 වසරේ දී ඉංග්රීසි ජාතික ගුරුවරයෙකු සහ ස්වභාව දාර්ශනිකයෙකු වූ ජෝන් ඩෝල්ටන් මූලද්රව්ය හැමවිටම කුඩා පූර්ණ සංඛ්යාමය අනුපාතවලින් ප්රතික්රියා කිරීම (ගුණානුපාත නියමය) සහ සමහරක් වායූන්ගේ ජල ද්රව්යතාව අනෙක් වායූන්ට වඩා ඉහළ අගයයක් ගැනීම පැහැදිලි කිරීම සඳහා පරමාණු පිළිබඳ සංකල්පය භාවිතා කළේය. එක් එක් මූලද්රව්යය අනන්ය එක් වර්ගයක පරමාණුවලින් සමන්විත වන බවත් රසායනික සංයෝග නිර්මාණය වන පරිදි මෙම පරමාණුවලට එකිනෙක හා සම්බන්ධ විය හැකි බවත් ඔහු යෝජනා කළේය.
1827 වසරේ දී උද්භිත විද්යාඥ රොබට් බ්රවුන් ජලයෙහි පාවෙන දූවිලි අංශ අණ්වීක්ෂයෙන් නිරීක්ෂණය කළ අතර එහි දී එම අංශු අහඹු ලෙස චලිත වන බව ඔහු නිරීක්ෂණය කළේය. මෙම සංසිද්ධිය වර්තමානයේ දී බ්රවුනීය චලිතය ලෙස හැඳින්වෙන අතර එමගින් අංශුවාදයේ (ඒ අනුවම පරමාණුක වාදයේ) සත්යභාවය තවදුරටත් පැහැදිලි විය. 1877 වසරේ දී ජේ.ඩිසෝක්ස් මෙම සංසිද්ධියට ජල අණුවල තාපජ චලිතය හේතු වේ යැයි යෝජනා කළ අතර 1905 වසරේ දී මුල්වරට ඇල්බට් අයින්ස්ටයින් මෙම චලිතය ගණිතමය වශයෙන් විශ්ලේෂණය කිරීමක් සමඟ එම කල්පිතය නිවැරදි බව තහවුරු විය.
1897 දී භෞතික විද්යාඥ ජේ.ජේ. තොම්සන් සිය කැතෝඩ කිරණ ආශ්රිත පර්යේෂණ ඔස්සේ ඉලෙක්ට්රෝනය සහ එහි උප පරමාණුක ගුණ සොයා ගත් අතර ඒ සමඟම පරමාණු තවදුරටත් බෙදිය නොහැකි බවට තිබූ මතය බිඳ වැටුණි. ඉලෙක්ට්රෝන පරමාණුව පුරා ව්යාප්තව ඇති බවත් ඒවායේ ආරෝපණය ඒවා මෙන්ම ඒකාකාරව පැතිරුණු ධන ආරෝපණ සමූහයක පැවැත්ම මඟින් තුල්ය වන බවත් (ප්ලං පුඩිං ආකෘතිය) තොම්සන්ගේ විශ්වාසය විය.
කෙසේ නමුත් 1909 වසරේදී භෞතික විද්යාඥ අර්නස්ට් රදර්ෆඩ් ගේ මෙහෙයවීම යටතේ පර්යේෂකයන් පිරිසක් තුනී රත්රන් තහඩුවක් මතට හීලියම් අයන විවර්තනය කර එහි ප්රතිඵල නිරීක්ෂණය කළ අතර එහි දී හීලියම් අයන කුඩා ප්රතිශතයක් තොම්සන්ගේ ආකෘතිය මගින් අනාවැකි පල කළ ප්රමාණයට වඩා වැඩි කෝණයන්ගෙන් අපගමනය වී ඇති බැව් සොයා ගන්නා ලදී. මෙම ප්රතිඵල පැහැදිලි කිරීම සඳහා රදර්ෆඩ් විසින් පරමාණුවේ ව්යුහය සඳහා නව ආකෘතියක් (රදර්ෆඩ් ආකෘතිය) ඉදිරිපත් කරන ලදී. පරමාණුවෙහි ධන ආරෝපණ සහ එහි ස්කන්ධයෙන් වැඩි ප්රමාණයක් පරමාණුව මධ්යයෙහි වූ න්යෂ්ටියක් තුළ කේන්ද්රගතව ඇති බවත් එම න්යෂ්ටිය වටා ඉලෙක්ට්රෝන පරිභ්රමණය වන බවත් ඔහු යෝජනා කළේය. එවිට න්යෂ්ටියට ආසන්න පෙතක ගමන් කරන හීලියම් අයන වඩා විශාල කෝණවලින් අපගමනය වනු ඇත.
විකිරණශීලී ක්ෂය වීමේ ප්රතිඵල පිළිබඳ අධ්යයනය කරන අතරතුර 1913 වසරේදී විකිරණ රසායනඥ ෆ්රෙඩ්රික් සොඩී විසින් ආවර්තිතා වගුවේ එක් එක් ස්ථානය සඳහා පරමාණු වර්ග එකකට වැඩි සංඛ්යාවක් පැවතිය හැකි බව සොයා ගන්නා ලදී. පසුව මෙම එකම මූලද්රව්යයේ වෙනස් පරමාණු සඳහා සමස්ථානික යන අරුත ඇති “isotope” යන ඉංග්රීසි වදන මාග්රට් ටොඩ් විසින් හඳුන්වාදෙන ලදී. මේ අතර ජේ.ජේ. තොම්සන් අයනීකෘත වායු පිළිබඳ සිය පර්යේෂණ ඔස්සේ විවිධ වර්ගවල පරමාණු වෙන්කර ගැනීම සඳහා ක්රමවේදයක් නිර්මාණය කළ අතර මේ ක්රමය ඇසුරින් පසු කාලීන ස්ථායී සමස්ථානික සොයා ගන්නා ලදී.
1913 වසරේ දී භෞතික විද්යාඥයෙකු වූ නීල්ස් බෝර් රදර්ෆඩ්ගේ පරමාණුක ආකෘතිය සංශෝධනය කරන ලද අතර ඒ අනුව ඉලෙක්ට්රෝන නිශ්චිත කක්ෂවල පවතින බවත්, ඒවාට මෙම කක්ෂ අතර පැනීම කළ හැකි නමුත් අතරමැදි අවස්ථාවන් ඔස්සේ නිදහසේ න්යෂ්ටිය දෙසට හෝ ඉන් ඉවතට වක්රාකාර පථයන් ඔස්සේ චලිත විය නොහැකි බවත් ඔහු යෝජනා කළේය. ඉලෙක්ට්රෝනයක් මෙම නිශ්චිත කක්ෂ අතර චලිත වීම සඳහා නිශ්චිත ශක්ති ප්රමාණයක් අවශෝෂණය හෝ විමෝචනය වන ආලෝකය ප්රිස්මයක් තුළින් යැවූ විට බහු වර්ණාවලියක් ලැබේ. මෙම වර්ණාවලියේ දැකිය හැකි ස්ථිර රේඛාවල පැවැත්ම කක්ෂ අතර ඉලෙක්ට්රෝන හුවමාරුව මගින් සාර්ථකව පැහැදිලි කළ හැකි විය.
1924 ලුයිස් ඩි.බ්රෝග්ලි අංශු අතර යම්තාක් දුරට තරංගමය හැසිරීමත් දක්වතැයි යෝජනා කළ අතර 1926 වසරේ දී අර්වින් ශෝඩින්ගර් මෙම යෝජනාව ඇසුරින් අංශුවක් වෙනුවට ත්රිමාණ තරංග ආකාරයක් ලෙසට ඉලෙක්ට්රෝන විස්තර කෙරෙන ගණිතමය පරමාණුක ආකෘතියක් නිර්මාණය කළේය. ඉලෙක්ට්රෝන තරංග ආකාරයක් ලෙස විස්තර කිරීමත් සමගම එහි පිහිටුම සහ ගම්යතාව යන පරාමිතීන් යුගලම එකවර නිවැරදිව ලබා ගැනීම ගණිතමය වශයෙන් කළ නොහැක්කත් බවට පත් වේ. මෙය අවිනිශ්චිතතා මූලධර්මය ලෙස ප්රසිද්ධියට පත් විය. මෙම සංකල්පයට අනුව කිසියම් පිහිටුමක් සඳහා ඉලෙක්ට්රෝනයකට තිබිය හැකි ගම්යතා පරාසයක් හෝ කිසියම් ගම්යතාවක් තිබිය හැකි පිහිටුම් සංඛ්යාවක් පමණක් ලබා ගත හැකි වේ. නමුත් මෙමගින් එය පෙර භාවිතා වූ ආකෘතීන් මඟින් පැහැදිලි කළ නොහැකි වූ හයිඩ්රජන්ට වඩා විශාල පරමාණුවල ව්යුහමය වර්ණාවලි රේඛා රටා වැනි පරමාණුක හැසිරීම් සම්බන්ධ නිරීක්ෂණ පැහැදිලි කළ හැකි විය. ඒ අනුව පරමාණු පිළිබඳ වූ ග්රහ මණ්ඩල ආකෘතිය ඉවත හෙලූ අතර ඒ වෙනුවට න්යෂ්ටිය වටා ඉලෙක්ට්රෝන පිහිටීමට වැඩිම සම්භාවිතාවක් පවතින කාක්ෂීය කලාප විස්තර කෙරුණු ආකෘතිය භාවිතයට පැමිණියේය.
ස්කන්ධ වර්ණාවලීක්ෂය දියුණු වීමත් සමග පරමාණුවල ස්කන්ධය නිවැරදිව මැනිය හැකි විය. මෙම උපකරණයේ දී චුම්භකයක් යොදා ගෙන අයන දහරාවක ගමන් මඟ වෙනස් කෙරෙන අතර එහි දී එක් එක් අයනයේ සිදු වන අපගමනය එම අයනයේ ස්කන්ධය (පරමාණුවෙහි ස්කන්ධයම වේ) එහි ආරෝපණයට දරන අනුපාතය මත රඳා පවතී. රසායන විද්යාඥ ෆ්රැන්සිස් විලියම් ඇස්ටන් මෙම උපකරණය යොදා ගෙන සමස්ථානිකවලට එකිනෙකට වෙනස් ස්කන්ධය පූර්ණ සංඛ්යාමය ප්රමාණවලින් එකිනෙකට වෙනස් වූ අතර මෙය පූර්ණ සංඛ්යා නියමය ලෙස හැඳින්වේ. මෙම එකිනෙකට වෙනස් පරමාණුක සමස්ථානිකවල පැවැත්ම පැහැදිලි කළ හැකි වූයේ භෞතික විද්යාඥ ජේම්ස් චැඩ්වික් විසින් 1932 වසරේදී ප්රෝටෝනයකට ස්කන්ධයෙන් සමාන, ආරෝපණයක් රහිත, නියුට්රෝනය නම් අංශුව සොයා ගැනීමෙන් පසුවය. ඒ අනුව සමස්ථානික සමාන ප්රෝටෝන සංඛ්යාවක් දරන, එහෙත් වෙනස් නියුට්රෝන සංඛ්යාවක් න්යෂ්ටිය තුළ අඩංගු වන මූලද්රව්ය පරමාණු ලෙස පැහැදිලි කරන ලදී.
1950 වර්ෂයට ආසන්න කාලය තුළ වඩාත් වැඩි දියුණු කළ අංශු ත්වරක සහ අංශු අනාවරක භාවිතයට පැමිණීමත් සමග අධි ශක්තියකින් යුතුව චලනය වන පරමාණු අතර ගැටුම් අධ්යයනය කිරීමේ අවස්ථාව විද්යාඥයන්ට උදා විය. මේ අනුව නියුට්රෝන සහ ප්රෝටෝන ක්වාක් නම් වඩාත් කුඩා අංශුවලින් සැදී ඇති හැඩ්රෝන බව සොයා ගන්නා ලදී. මෙම උප පරමාණුක අංශු සහ ඒවායේ අන්තර් ක්රියාවන් පාලනය කරන බල ඇසුරින් සාර්ථක ලෙස න්යෂ්ටියෙහි ගුණාංග පැහැදිලි කළ හැකි න්යෂ්ටික භෞතික විද්යාත්මක සම්මත ආකෘතීන් මේ සමගම වැඩි දියුණු විය.
1985 දී පමණ “Bell Labs” පර්යේෂණාගාරයේ දී ස්ටීවන් චූ සහ ඔහුගේ සහායකයින් විසින් ලේසර් භාවිතායෙන් පරමාණු සිසිල් කළ හැකි තාක්ෂණික ක්රමයක් ගොඩනඟන ලදී. එම වසර තුළදීම විලියම් ඩී. පිලිප්ස් විසින් මෙහෙයවූ කණ්ඩායමක් චුම්භක උගුලක් ඇසුරින් සෝඩියම් පරමාණු රඳවා ගත හැකි ක්රමයක් සොයා ගන්නා ලදී. ක්ලෝඩ් කෙහෙන් ටැනෝජි සහ ඔහුගේ කණ්ඩායම විසින් ඩොප්ලර් ආචරණය පදනම්ව නිර්මාණය කළ ක්රමවේදයක් ඉහත මුල් සොයා ගැනීම් යුගල හා එක්ව භාවිත කරමින් පරමාණු කුඩා සංඛ්යාවක් ඒවායේ උෂ්ණත්ව මයික්රො කෙල්වින් කිහිපයක් වන තෙක් සිසිල් කළ හැක. මේ මගින් පරමාණු ඉහළ නිරවද්යතාවයකින් අධ්යයනය කළ හැකි වන අතර පසු කාලීනව මේ ඔස්සේ බෝස් - අයින්ස්ටයින් සංඝණික සොයා ගන්නා ලදී.
අතීතයේ දී විද්යාත්මක ක්රියාවලීන් යෙදිය නොහැකි තරම් පරමාණුවෙහි ප්රමාණය කුඩා යැයි සැලකුණි. නමුත් මේ වන විට තනි ඉලෙක්ට්රෝන ට්රාන්සිස්ටරයක් ලැබෙන පරිදි කාබනික බන්ධ කාණ්ඩ ඔස්සේ සම්බන්ධ වූ තනි ලෝහ පරමාණුවක් අඩංගු ව්යුහයක් නිර්මාණය කර ඇති. මේ අතර ලේසර් සිසිලනය යොදා ගෙන කුහරයක් තුළ තනි පරමාණුවල වේගය අඩු කොට ඒවා රඳවා ගනිමින් පදාර්ථය පිළිබඳ වඩාත් නිවැරදි අදහසක් ලබා ගැනීම සඳහා ඒවා අධ්යයනය කිරීම ද සිදු කර තිබේ.
පරමාණු අනන්යකරණය
[සංස්කරණය]
(Scanning tunneling අණ්වීක්ෂයක) , පරමාණු මට්ටමේ ඇති නොයෙකුත් තල පැහැදිලිව දැක ගැනීමට යොදා ගනී. එය ක්වොන්ටම් (tunneling සිද්ධිය) යොදා ගන්නා අතර, එමගින් අංශුවලට, පාරගම්ය වූ බාධකයක් හරහා වුව ද ගමන් කිරීමට ඉඩ සලසා දෙයි. පරමාණු අවශෝෂණය කළ ලෝහ ඉලෙක්ට්රෝඩ දෙකක් අතර ඇති රික්තය තුළින් ඉලෙක්ට්රෝන ගමන් කරනුයේ (Scanning tunneling නලයේ) ඝනත්වය වැඩි කරමිනි. එක් පරමාණුවක් සියුම් ලෙස පරීක්ෂා කිරීමෙන් හා එහි ගමන් මාර්ගය අධීක්ෂණය කිරීමෙන්, යම් විද්යුත් ධාරාවක පාර්ශ්වික වියෝජනයට එරෙහිව පරමාණුවේ අස්ථානගතවීම පැහැදිලිකර දෙයි. (මෙමගින් අදාල අන්වීක්ෂයෙන් ගන්නා ලද තනි පරමාණුවක ඡායාරූපවල දෘශ්ය භාවය පැහැදිලි කර දෙයි. මෙමගින් අන්වීක්ෂය පරමාණුවේ අවකාශමානයේ කාක්ෂිකවල ශක්ති මට්ටම් අනුව ඡායාරූපගත කිරීම අඩු නැඹුරුතාවක් දක්වන බව පෙනී යයි.) මෙය Fermi level local density of states නමින් හැඳින්වේ.
පරමාණුවකට ඉලෙක්ට්රෝන ඉවත් කිරීමෙන් අයනීකරණය විය හැක. (විද්යුත් ආරෝපණය) පරමාණුවේ (පරාවක්රය) චුම්භක ක්ෂේත්රයක දී යම් නැමීමකට ලක් කරයි. චලිත අයනයක පරාවක්රයේ අරය තීරණය වනුයේ පරමාණුවේ ස්කන්ධය මගිනි. ස්කන්ධ වර්ණාවලිමානය මෙම මූලධර්මය යොදා ගනිමින් අයනවල ස්කන්ධය හා ආරෝපණය අතර අනුපාතය මනී. එක් සාම්පලයක සමස්ථානික බොහොමයක් තිබුණහොත්, ස්කන්ධ වර්ණාවලිමානයට අයනයේ නොයෙකුත් කිරණවල තීව්රතාව මැනීමෙන් එක් එක් සමස්ථානිකයේ ප්රතිශතය ගණනය කළ හැකිය. පරමාණු වාෂ්පීකරණයට, පහත ක්රමවේදයන් අඩංගු වේ.
1) ප්රේරක යුගලනය වූ පරමාණුක ප්ලාස්මා විමෝචන වර්ණාවලීක්ෂණය 2) ප්රේරක යුගලනය වූ ප්ලාස්මා ස්කන්ධ වර්ණාවලිමානය.
මෙම ක්රම දෙකම, වාෂ්පීකරණය වූ සාම්පල අධීක්ෂණයට ප්ලාස්මාවක් යොදා ගනී.
තව දුරටත් සුදුසු ක්රමවේදයක් වනුයේ “ඉලෙක්ට්රෝන ශක්ති - හානි වර්ණාවලීක්ෂණයයි” මෙමගින් (transmission ඉලෙක්ට්රෝන අන්වීක්ෂයක) ඇති ඉලෙක්ට්රෝන කදම්බයක ශක්ති හානිය ගණනය කරයි. මෙම පරමාණු - පරීක්ෂණ විකිරණ ක්රම වේදයට ත්රිමාණව උප නැනෝ මීටර විසඳුමක් තිබෙන අතර එයට ස්කන්ධ වර්ණාවලීක්ෂණය භාවිතයෙන් රසායනිකව තනි පරමාණු හඳුනාගැනීමට ද හැක.
උත්තේජිත තත්වවලදී වර්ණාවලියෙන් තාරකාවල පරමාණුක සංයෝජනය නිර්ණය කළ හැක. විශිෂ්ට ආලෝක තරංග ආයාමයන් (තාරකාවල ආලෝකයෙන්) වෙන් කරගත හැකි අතර, නිදහස් වායු පරමාණුවල ක්වොන්ටිනීකරණ සංක්රාමණයට එය දක්වන සම්බන්ධය ද සොයා ගත හැක. මෙම වර්ණ, එකම මූලද්රව්ය අඩංගුව ඇති වායු - මුදාහරින ලාම්පුව මගින් ද සාදා ගත හැක. මේ අයුරින් හිරුගේ වර්ණාවලිය භාවිතයෙන්, පෘථිවියේ සොයාගැනීමට වසර 23ට පෙර, හිරු මත හීලියම් සොයා ගැණුනි.
න්යෂ්ටිය
[සංස්කරණය]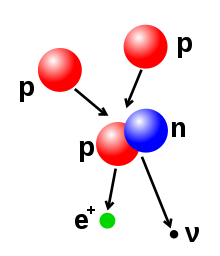
නියුක්ලියෝන ලෙස හදුන්වන නියුට්රෝන හා ප්රෝටෝන එකතු වී කුඩා පරමාණුක න්යෂ්ටි නිර්මාණය වේ. න්යෂ්ටියක අරය දල වශයෙන් fm පමණ වන අතර මෙහි A මගින් මුළු නියුක්ලියෝන සංඛ්යාව දැක්වේ. මෙය 105 fm ගණයේ ඇති පරමාණුක අරයක් සමග සැසදීමේදී ඉතා කුඩාය. කුඩා පරාසයක පැතිරී ඇති ‘අවශේෂ ප්රභල බලය’ නමින් හඳුන්වන ආකර්ශන විභවයක් මගින් නියුක්ලියෝන එකට බන්ධනය වී ඇත. 2.5 fm ට වඩා කුඩා දුරවල දී ධන ආරෝපිත ප්රොටෝන වලට එකිනෙක විකර්ශනය කිරිමට හේතුවන විද්යුත් චුම්භක බලයට වඩා මෙම බලය බල සම්පන්නය.
එකම මුලද්රව්යයේ ප්රෝටෝන ගණන සමානවන අතර එය පරමාණුක ක්රමාංකය ලෙස හඳුන්වයි. එකම මුලද්රව්යයේ නියුට්රෝන වෙනස් විය හැකි අතර එමගින් මුලද්රව්යයේ සමස්ථානික ඇතිවේ. න්යෂ්ටියේ ස්ථායීතාව තීරණය කරන්නේ එහි නියුට්රෝන ගණනට සාපේක්ෂව ඇති ප්රෝටෝන ගණනයි. අස්ථායී සමස්ථානික වෙතොත් ඒවා විකිරණශීලී ක්ෂය වීම් වලට භාජනය වේ.
නියුට්රෝන හා ප්රෝටෝන වෙනස් වර්ගවල ෆමියෝන වේ. පව්ලිගේ බහිෂ්කාර නියමය යන ක්වොන්ටම් යාන්ත්රණයට අනුව සර්වසම ෆමියෝන 2ක් එකවර එකම ක්වොන්ටම් භෞතික මට්ටමට එළඹිය නොහැක. එනම් න්යෂ්ටියේ ඇති සියලු ප්රෝටෝන ඒවාට අනන්ය ශක්ති මට්ටම සමගින් වෙනස් තත්ව පවත්වා ගත යුතු අතර සියලුම නියුට්රෝන සඳහා ද මෙම නියමය වලංගු වේ. (මෙය එකට ක්වොන්ටම් තත්වයක අයත් කර ගෙන සිටින නියුට්රෝනකය හා ප්රෝටෝනයකට වලංගු නොවේ.)
නියුට්රෝන සංඛ්යාවට අසමාන ප්රෝටෝන සංඛ්යාවක් ඇති න්යෂ්ටි , නියුට්රෝන සංඛ්යාව හා ප්රෝටෝන සංඛ්යාවට තවත් ලං වන සේ විකිරණශීලී ක්ෂය වීම්වලට භාජනය වී පහළ ශක්ති මට්ටම් කරා එළඹේ. නියුට්රෝන හා ප්රෝටෝන ගණන සමාන න්යෂ්ටි විකිරණශීලී ක්ෂය වීම කෙරෙහි ස්ථායී වේ. නමුත් පරමාණුක ක්රමාංකය වැඩිවන විට ප්රෝටෝන අතර ඇතිවන අන්යෝන්ය විකර්ෂණය නිසා න්යෂ්ටියේ ස්ථායීතාවය පත්වා ගැනීමට නියුට්රෝන සංඛ්යාවට සමානුපාතිකව ඉහළ හා යුතුය. මෙහිදී නියුට්රෝන ගණනය හා ප්රෝටෝන ගණන සමාන විමේ ප්රවණතාව යම්තාක් දුරකට නවීකරණය වෙයි.
දුර්ලභ හා සිද්ධාන්තමය ආකාර
[සංස්කරණය]පරමාණුක ක්රමාංකය 82ට වැඩි (ඊයම්වල) මූලද්රව්ය හා ඒවායේ සමස්ථානිකයන් විකිරණශීලී මූලද්රව්යය වේ. නමුත් ‘සමතුලිත දූපත්’ වශයෙන් හදුන්වන පරමාණුක ක්රමාංකය 103 ට වැඩි මූලද්රව්ය ද පවතී. ඒවා අධි ස්කන්ධ මූලද්රව්ය (Superheavy –elements) ලෙස හැදින්වේ. මේවායේ න්යෂ්ටි බොහෝ විකිරණශීලී මූලද්රව්ය න්යෂ්ටිවලට සාපේක්ෂව ස්ථායී වේ. ස්ථායී අධි ස්කන්ධ මූලද්රව්යයක් වන උන්බිහෙක්සියම් (unbihexium) එයට හොදම උදාහරණය වන අතර එය සතුව ප්රෝටෝන 126 ක් හා නියුට්රෝන 184 ක් පවතී.
පදාර්ථෙය් සෑම අංශුවකටම සමරූපී ප්රතිපදාර්ථ අංශුවක් ඇති අතර එය විද්යුත් වශයෙන් ප්රතිවිරුද්ධ ආරෝපණයක් ගනී. එනම් පොසිට්රෝනයක් යනු ධන ආරෝපිත ප්රති ඉලෙක්ට්රෝනයක් වන අතර එමෙන්ම ප්රතිප්රෝටෝනයක් යනු සෘණව ආරෝපිත වූ ප්රෝටෝනයක් වේ. කෙසේ හෝ අප නොදන්නා හේතුවකට ප්රතිපදාර්ථමය අංශූන් විශ්වයේ දුර්ලභ වේ. එසේම තවමත් ප්රතිපදාර්ථ න්යෂ්ටියේ සොයාගෙන නැත . ප්රතිහයිඩ්රජන් යනු හයිඩ්රජන්හි ප්රතිපදාර්ථය වන අතර එය ජිනීවාහි CERN විද්යාගාරයේදී නිපදවන ලදී.(1996)
එමෙන්ම තවත් විශ්මය ජනක පරමාණු නිපදවා ඇත. එහිදී ප්රෝටෝන නියුට්රෝන හා ඉලෙක්ට්රෝන වෙනුවට තවත් එම ආරෝපණයම දරණ වෙනත් අංශු ඇතුළු කිරීමෙන් අදාල පරමාණුව නිපදවා ඇත. උදාහරණ වශයෙන් ඉලෙක්ට්රෝනයක් වෙනුවට මියුඕන් (muon) එක් කිරීමෙන් මියුඕන න්යෂ්ටියක් සෑදේ. (muonic atom) මෙවැනි න්යෂ්ටි භාවිතා කරමින් භෞතික විද්යාවේ මූලධර්ම පිළිබද අනාවැකි කීමට යොදා ගන්නා පරීක්ෂණවලට යොදාගනී.
ඉලෙක්ට්රෝන වලාව
[සංස්කරණය]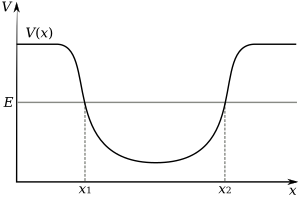
න්යෂ්ටියේ ඇති ප්රෝටෝන මගින් ඉලෙක්ට්රෝන විද්යුත් චුම්භකබල මගින් ආකර්ෂණය කර ගනු ලබයි. මෙම බලය නිසා ඉලෙක්ට්රෝන, ස්ථිති විද්යුත් විභව කූපය පවතිමින් කුඩා න්යෂ්ටිය වටා පිහිටයි. එනම් මෙම ඉලෙක්ට්රෝනයක් න්යෂ්ටියෙන් ඉවත් කිරීමට නම් බාහිර බලයක් දිය යුතුය යන්නය. න්යෂ්ටියට ආසන්නව පිහිටි ඉලෙක්ට්රෝනයක් ඉතා තදින් න්යෂ්ටියට ඇදී බැදී පවතී. මේ නිසා විභව විභව කූපයෙහි මධ්යයට ආසන්නව පිහිටි ඉලෙක්ට්රෝන මුදා ගැනීමට විභව කූපයේ බාහිරව පිහිටි ඉලෙක්ට්රෝනවලට සැපයිය යුතු ශක්තියට වඩා වැඩි ශක්තියක් සැපයිය යුතු වේ.
ආනෙක් අංශුවලට මෙන් ඉලෙක්ට්රෝනවලට අංශුමය හා තරංගමය ගුණ ඇත. ඉලෙක්ට්රෝන වලාව යනු විභව කූපයේ ඉලෙක්ට්රෝන ත්රිමානව ස්ථාවර තරංගයක ආකාරයෙන්, න්යෂ්ටියට සාපේක්ෂව චලනය නොවී පවතින ප්රදේශයකි. මෙම හැසිරීම පරමාණුක කක්ෂික මගින් පැහැදිලි කළ හැක. මෙය ගණිතමය ශ්රීතයක් වන අතර එමගින් ඉලෙක්ට්රෝනයක යම් ගණනය කරන ලද පිහිටීමක පැවතීමේ සම්භාවිතාවය ගණනය කරයි. අනෙකුත් විය හැකි තරංග රටා ස්ථායි ආකාරයට වෙනස් විය හැකි නිසා න්යෂ්ටිය වටා පවතින්නේ ව්යුක්තව පවතින්නේ කාක්ෂික කාණ්ඩයක් පමණි. කාක්ෂික සදහා එක වලයකට නිෂ්පාදනයකට වඩා තිබිය හැකි අතර ඒවා හැඩයෙන්, ප්රමාණයෙන් හා ස්ථානගත වීමෙන් එකිනෙකට වෙනස් වේ.

ඉහත එක් පරමාණුක කාක්ෂිකයක් ඉලෙක්ට්රෝනයේ විශේෂිත ශක්ති මට්ටමකට අනුරූප වේ. ඉලෙක්ට්රෝනය, නව ක්වෝනටම් මට්ටමකට යාමට තරම් අවශ්ය ශක්තියක් ඇති ප්රෝටෝනයක් අවශෝෂණය කර වැඩි ශක්ති මට්ටමකට යා හැකිය. එමෙන්ම නිසඟ විමෝචනය කිරීම් වලින් වැඩි ශක්තිය ප්රෝටෝනයක් ලෙස විකිරණය කිරීමෙන් වැඩි ශක්ති මට්ටමක සිටින ඉලෙක්ට්රෝනයකට ද අඩු ශක්ති මට්ටමකට පත් විය හැක. කෝන්ටම් තත්ත්ව වල ශක්ති වල වෙනස් වීම් මගින් අර්ථ දක්වා ඇති මෙම ලක්ෂණික ශක්ති අගයන්, පරමාණුක වර්ණාවලි රේඛා සදහා හේතු පාදක වේ.
ඉලෙක්ට්රෝන ඇතුළු කිරීම හෝ ඉවත් කිරීමට අවශ්ය ශක්තිය, නියුක්ලියෝන බන්ධන ශක්තියට වඩා බොහෝ සෙයින් අඩුය. උදා- හයිඩ්රජන් පරමාණුවේ භූමි අවස්ථාවේ පවතින ඉලෙක්ට්රෝනයක් ඉවත් කිරීමට අවශ්ය වනුයේ 13.6eV කි. පරමාණුව විද්යුත් වශයෙන් උදාසීන වන්නේ පරමාණු තුළ පවතින ප්රෝටෝන ගණනට සමාන ඉලෙක්ට්රෝන ගණනක් අන්තර් ගත වන්නේ නම් පමණි. පරමාණුවක ඉලෙක්ට්රෝන අතිරික්තයක් හෝ ඌණතාවයක් ඇත්නම් ඒවා අයන ලෙස හදුන්වයි. න්යෂ්ටියට ඉතා ඈතින් පිහිටි ඉලෙක්ට්රෝන අනෙක් පරමාණුවලට ලබාදීම හෝ අනෙක් පරමාණු සමග හවුලේ තබාගැනීම සිදු විය හැකිය. මෙම ක්රියාමාර්ග මගින් අනුවලට හා අයනික හා සහ සංයුජ දැලිස් ස්ඵටික වැනි වෙනත් වර්ග වල රසායනික සංයෝග වලට බැදීමට ඉලෙක්ට්රෝන වලට අවශ්ය අවකාශය ලබාදෙයි.
උප පරමාණුක අංශු
[සංස්කරණය]මූලික භාවිතයේදී “පරමාණුව” (Atom) යනුවෙන් අදහස් වන්නේ බෙදා වෙන්කළ නොහැකි අංශුව යන්නයි. නමුත් වර්තමානයේ විද්යාඥයෝ පරමාණුවක අඩංගු උප පරමාණුක අංශු ලෙස ප්රෝටෝන හා ඉලෙක්ට්රෝන සලකයි. හයිඩ්රජන් -1 (IH) හැරුණු විට අන් සියලු පරමාණු තවත් උප පරමාණුක අංශුවක් වන නියුට්රෝනද දරති.
මේ අතරින් කුඩාතම වන්නේ ඉලෙක්ට්රෝනයයි. එහි ස්කන්ධය 9.11 x 10-28g වන අතර එහි ප්රමාණය දැනට පවතින ස්කන්ධ මනින ක්රම මගින් මැනිය නොහැකි තරම් කුඩා වේ. ඉලෙක්ට්රෝන සෘණ ආරෝපිත වේ. ප්රෝටෝනයක ස්කන්ධය 1.6726 x 10-24 g වන අතර එය ආසන්න වශයෙන් ඉලෙක්ට්රෝනයෙහි ස්කන්ධය මෙන් 1836 ගුණයක් පමණ වේ. එහෙත් ප්රෝටෝනයක ස්කන්ධය ඒම ප්රෝටෝන බැඳී ඇති න්යෂ්ටික බන්ධන ශක්තිය අනුව විචල්ය වේ. ප්රෝටෝන ධන අරෝපිත වේ. නියුට්රෝනවලට විද්යුත් ආරෝපණයක් නැති අතර දළ වශයෙන් ඉලෙක්ට්රෝනයක් මෙන් 1839 ගුණයක් පමණ, එනම් 1.6929 x 10-24g ක ස්කන්ධයක් සහිත වන අතර ප්රෝටෝන හා නියුට්රෝන යන අංශු දෙවර්ගයම ආසන්න වශයෙන් 2.5 x 10-15 m ගණයේ විශාලත්වයකින් යුක්ත වේ. එහෙත් ප්රෝටෝන හෝ නියුට්රෝනවල මතු පිට ස්වභාවය මේ වන තෙක් පැහැදිලිව අධ්යයනය කිරීමට නොහැකි වී තිබේ.
භෞතික විද්යාවේදී දැනට පිළිගත් සම්මතයන්ට අනුව නියුට්රෝන හා ප්රෝටෝන සෑදී ඇත්තේ “ක්වාක්” යනුවෙන් හැඳින්වෙන වඩාත් කුඩා අංශුවලිනි. ක්වාක් නම් උප පරමාණුක අංශුව “ෆර්මියෝන්” යනුවෙන් හැදින්වෙන උප පරමාණුක අංශු වර්ගයට අයත් වන අතර මෙම ෆර්මියෝනු සහ ලෙප්ටෝන ලෙස හැඳින්වෙන තවත් උප පරමාණුක අංශු වර්ගයක් සියලුම පදාර්ථයේ මූලික තැනුම් ඒකකය බව පිළිගැනේ. ඉලෙක්ට්රෝන ලෙප්ටෝන සඳහා එක් උදාහරණයකි. ක්වාක් වර්ග 6 ක් පවතින අතර ඒවා සියල්ලම +2/3 ක හෝ -1/3 ක ආරෝපණයක් දරණ අංශු වේ. ප්රෝටෝනයක් සමන්විත වන්නේ “ඉහළ ක්වාක්” (up quark) අංශු දෙකක් හා එක් “පහළ ක්වාක්” (down quark) අංශුවකිනි. “ඉහළ ක්වාක්” අංශුවක් හා “පහළ ක්වාක්” අංශු දෙකකින් නියුට්රෝනයක් සමන්විත වේ. මෙම මූලික සැකසුම අනුව නියුට්රෝනයක් හා ප්රෝටෝනයක් අතර පවතින ස්කන්ධයේ හා ආරෝපණයේ වෙනස පැහැදිලි කළ හැකිය. ක්වාක් එකිනෙක බැඳ තබාගැනීම සඳහා ඉතා ශක්තිමත් න්යෂ්ටික බන්ධන ආධාර වේ. බන්ධන හටගැනීම හා පවත්වා ගැනීමට මාධ්ය ලෙස ග්ලූවොන් නමින් හැඳින්වෙන ද්රව්යය ක්රියාකරයි. එනම් එම අංශු ඔස්සේ මෙම බන්ධන ශක්ති සම්ප්රේෂණය සිදු වේ. ග්ලූවෝන් අංශු, බොසෝන් යන අංශු වර්ගයට අයත් වන අතර බොසෝන භෞතික ශක්තීන් සම්ප්රේෂක ලෙස ක්රියාකළ මූලික අංශු වර්ගයයි.
චුම්භක ඝූර්ණය
[සංස්කරණය]පරමාණුවක අංශු ‘බැමුම’ ලෙස හඳුන්වන නිසග ක්වොන්ටම් යාන්ත්රික ගුණයක් දරයි. මෙය වස්තුවක ස්කන්ධ කේන්ද්රය වටා භ්රමණයවන වස්තුවක කෝණික ගම්යතාවට සමාකාරවන නමුත් මෙම අංශු ලක්ෂාකාර නිසා භ්රමණය වේ යැයි පැවසිය නොහැක. ‘බමන’ මනිනු ලබන්නේ ප්ලාන්ක් නියතයේ ඒකක වලින් වන අතර ඉලෙක්ට්රෝන, ප්රෝටෝන හා නියුට්රෝන සියල්ලටම ඇත්තේ ‘ස්පින් ½’ හෝ ‘ස්පින් -1/2’ ය. පරමාණුවක බමනවලට අමතරව න්යෂ්ටිය වටා ඉලෙක්ට්රෝනවල චලිතය ඇති කරන කාක්ෂීය කෝණික ගම්යතාව ද ඇත. ඒ අතරම න්යෂ්ටිය එහි න්යෂ්ටික බමනය නිසා කෝණික ගම්යතාවක් ඇති කර ගනී.
පරමාණුවක් මගින් ඇති කරනු ලබන චුම්භක ක්ෂේත්රය - එහි චුම්භක ඝුර්ණය කෝණික ගම්යතාවේ සියළුම ස්වරූප මගින් තීරණය කරනු ලබයි. සරළ ලෙස භ්රමණයවන ආරෝපිත වස්තුවක් චුම්භක ක්ෂේත්රයක් ඇති කරනු ලබයි. කෙසේ මුත් වඩාත් වැදගත් දායකත්වයක් ලැබෙන්නේ බමනය මගිනි. පව්ලිගේ බහිෂ්කාර මුලධර්මයට අනුකූලව , ඉලෙක්ට්රෝන දෙකක් එකම ක්වොන්ටම් මට්ටමේ නොතිබිය යුතුයි නිසා බන්ධන ඉලෙක්ට්රෝන එකිනෙකට යුගලනය වන්නේ සෑම යුගලයකට එක් සාමාජිකයෙක් ඉහළ බමන අවස්ථාවේ ද අනික, ප්රතිවිරුද්ධ එනම්, පහළ බමන අවස්ථාවේ ද ඇති පරිදිය. මෙම බමන එකිනෙක නිශේදනය කරන නිසා ඉලෙක්ට්රෝන ඇති පරමාණුවල පවා මුල් චුම්භක ද්වි ධ්රැව ඝුර්ණය බින්දුවක් වේ.
යකඩ වැනි අයශ්චුම්භක මුලද්රව්යවල දී ඉලෙක්ට්රෝන ගණන යුගලනය නොවූ ඉලෙක්ට්රෝනයකට මග පාදන අතර එමගින් ශුද්ධ චුම්භක ඝූර්ණයකට මග පාදයි.යාබද පරමාණු වල කාක්ෂික අතිඡඡාදනය වන අතර අඩු ශක්ති මට්ටමක් ලඟාකර ගනී.මෙලෙස යුගලනය නොවු ඉලෙක්ට්රෝන එකිනෙක පෙල ගසී පවතින විට මෙම ක්රියාවලිය හුවමාරු අන්තර් ක්රියාව ලෙස හදුන්වනු ලබයි. අයශ්චුම්භක පරමාණුවල චුම්භක ඝූර්ණය පෙළ ගැස්වූවිට එම ද්රව්යයට මැනිය හැකි මහේක්ෂීය ක්ෂේත්රයක් ගොඩ නැංවිය හැකිය. අනු ක්ෂේත්ර චුම්භක ද්රව්ය , චුම්භක ක්ෂේත්ර තුළ නොමැති වීම විවිධ දිශාවලට හැරුණු චුම්භක ඝූර්ණ සහිත පරමාණුවලින් යුක්ත වේ. නමුත් ක්ෂේත්රයක් ඇති විට සියළු මාණුවල චුම්භක ඝූර්ණ එකිනෙක පෙළ ගැසේ.
පරමාණුවක න්යෂ්ටියට ශුද්ධ බමනයක් පැවතිය හැක. සාමාන්යයෙන් මෙම න්යෂ්ටි තාපජ සමතුලිතය නිසා විවිධ දිශා ඔස්සේ හැරී ඇත. කෙසේ නමුත් සමහර මුලද්රව්ය (සෙනන් 129 – Xenon) වලට න්යෂ්ටිවල න්යෂ්ටික බමන තත්වය සැලකිය යුතු ප්රමාණයක් ධ්රැවීකරණය කර එක් දිශාවකට යොමු කිරීමේ හැකියාව ඇත. මෙම තත්වය අධි ධ්රැවීකරණය ලෙස හඳුන්වනු ලබයි. චුම්භක සම්ප්රයුක්ති මුර්තකයෙහි මෙහි වැදගත් යෙදීමක් ඇත.
පදාර්ථයේ අවස්ථා
[සංස්කරණය]
පරමාණු විශාල සංඛ්යාවක් බැගින් පවතින භෞතික තත්ව, එනම් උෂ්ණත්වය හා පීඩනය මත පදනම්ව පදාර්ථයේ විවිධ අවස්ථාවල පැවතීම නිරීක්ෂණය කළ හැක. මෙම භෞතික තත්ව විචල්යය මගින් පදාර්ථයේ එහි විවිධ අවස්ථා වන ඝන, ද්රව, වායු හා ප්ලස්මා තත්වයන්ට පරිවර්තනය කළ හැක. තවද එකම මූලද්රව්යයේ එකම භෞතික කාලයක් තුළ වෙනස් ක්රම වලින් පැවතිය හැක. (උදා - දියමන්ති හා මිනිරන් )
කෙල්වින් 0 ට ආසන්න උෂ්ණත්වයේදී “බෝස් - අයින්ස්ටයින් සංසතික” තත්වයට පරමාණු සමූහ පත්වේ. එවිට සාමාන්ය තත්ව යටතේ පරමාණුක පරාසයේ පමණක් නිරීක්ෂණය කළ හැකි ක්වන්ටම් යාන්ත්රික බලපෑම් අන්වීක්ෂීය මට්ටමින් නිරීක්ෂණය කළ හැකි තත්වයට පත් වේ. එවිට මෙම අධිකව ශිතල කළ පරමාණු ගොණුව තනි පරමාණුවක් සේ හැසිරීමට පත් වේ. මෙම සංසිද්ධිය මූලික ක්වන්ටම් යාන්ත්රික හැසිරීම් පරීක්ෂා කිරීමට යොදාගත හැක.
පරමාණුක ස්කන්ධය
[සංස්කරණය]පරමාණුක ස්කන්ධය (m0) යනු එක් පරමාණුවක මුළු ස්කන්ධය වන අතර, එය බොහෝ විට පරමාණුක ස්කන්ධ ඒකක මගින් ප්රකාශ කරනු ලැබේ. පරමාණුක ස්කන්ධය යනු උදාසීන පරමාණුවක ප්රෝටෝන , නියුට්රෝන හා ඉලෙක්ට්රෝනවල ස්කන්ධයේ එකතුවය. ඇතැම් අවස්ථාවලදී පරමාණුක ස්කන්ධය යන්න සාපේක්ෂ පරමාණුක ස්කන්ධය , සාමාන්ය පරමාණුක ස්කන්ධය , පරමාණුක බර ආදී වචන සදහා සමාන පදයක් ලෙස භාවිතා වූවද , එය වැරදි සහගත වේ. මෙහිදී එක් අවස්ථාවක දී පරමාණුවක තිබිය හැක්කේ එක් සමස්ථානිකයක් පමණක් වන අතර, එය බහුතරයකගේ සාමාන්යය අගය නොවේ. බොහෝ මූලද්රව්යවල එක් ප්රධාන සමස්ථානිකයක් පවතින අතර, එවිට එම සමස්ථානිකයේ ස්කන්ධය හා සාපේක්ෂ පරමාණුක ස්කන්ධය අතර ඇත්තේ ඉතා සුළු වෙනසකි. එවිට එය නොගිණිය හැකි වුවත් , ඒක පරමාණුක වශයෙන් ගත් කළ එහි සැලකිය යුතු වෙනසක් සිදුවේ. එක් ප්රධාන සමස්ථානිකයකට වඩා පවතින මූලද්රව්යවල මෙම වෙනස පැහැදිලිව දැකගත හැකිය. (උදා : ක්ලෝරීන්) දුර්ලභ සමස්ථානිකවල මෙම වෙනස ඒකක කීපයක් විය හැකිය. සාපේක්ෂ පරමාණුක ස්කන්ධය (Ar) (පරමාණුක භාරය/ සාමාන්ය පරමාණුක ස්කන්ධය) සියලුම මූලද්රව්ය සමස්ථානිකයන්ගේ ස්කන්ධයේ සාමාන්ය අගය වන අතර, ඒ සදහා සාපේක්ෂ සමස්ථානික සුලභතාව ද බලපා ඇත. මෙය බොහෝ විට සම්මත පරමාණුක භාරයට සමාන අර්ථය ලබා දේ. සාපේක්ෂ පරමාණුක ස්කන්ධය භෞමික හා අභෞමික පරිසරයටද එකසේ යොදාගත හැකිය.
IUPAC කමිටුවේ පරමාණුක භාර හා සමස්ථානික සුලභත්වය පිළිබද පනතෙන් සම්මත පරමාණුක භාරය , පෘථිවි පෘෂ්ඨය මත ඕනෑම පරිසරයක ඇති මූලද්රව්යයක සාපේක්ෂ පරමාණුක ස්කන්ධයට සමාන බව සදහන්ව ඇත. මෙය ආවර්තිතා වගුවේ මූලද්රව්යවල සම්පූර්ණ බර ගණනයට යොදාගෙන ඇත. මෙහිදී නිවැරදිව ගණනය කිරීමට අපහසු බර, සාමාන්යය අගයක් වශයෙන් වරහන් තුළ අන්තර්ගතව ඇත. කෘත්රීම මූලද්රව්යවල වඩාත්ම ස්ථායී සමස්ථානිකයේ (එනම් දීර්ඝතම අර්ධ ආයු කාලය ඇති සමස්ථානිකයේ) මුළු නියුක්ලියෝන ගණන වරහන් තුළ යොදා සම්මත පරමාණුක ස්කන්ධය සදහන් විය යුතු ස්ථානයේ සදහන් කරයි. ලිතියම් මූලද්රව්යය මෙහිදී අද්විතීය කාර්යක් ඉටු කරයි. එයට හේතුව එහි සම්මත පරමාණුක භාරයේ අවිනිෂ්චිතභාවය පිරික්සීම උදෙසා ලිතියම්හි ස්වාභාවික සමස්ථානිකවල සුලභත්වය මිනිස් ක්රියාකාරකම් මගින් කැළඹීමකට ලක්වීමයි.
සාපේක්ෂ සමස්ථානික ස්කන්ධය මනිනු ලැබ ඇත්තේ කාබන් - 12 පරමාණුවේ ස්කන්ධය 12 ලෙස ගැනීමෙනි. බන්ධන ශක්තියේ වෙනස් වීම් හා නියුට්රෝන , ප්රෝටෝන වෙනස්වීම හේතුවෙන් අනෙකුත් කිසිදු මුලද්රව්ය සමස්ථානිකයක එසේ පූර්ණ සංඛ්යාවක් නොපවතී. කෙසේ වුවත් බන්ධන ශක්තිය හේතුවෙන් ඇති වන ස්කන්ධ හානිය, නියුක්ලියෝනයක ස්කන්ධයට සාපේක්ෂව අවම වන නිසා, සමස්ථානිකයක පරමාණුක ස්කන්ධය ඔබට පවසනුයේ මුළු නියුක්ලියෝන ගණනයි. එවිට නියුට්රෝන ගණන, මුළු නියුක්ලියෝන ගණනින් පරමාණුක ක්රමාංකය අඩු කිරීමෙන් සොයාගත හැකිය.
පරමාණුක ක්රමාංකය
[සංස්කරණය]රසායන විද්යාවේ දී හා භෞතික විද්යාවේ දී පරමාණුක ක්රමාංකය ලෙසින් හඳුන්වනුයේ පරමාණුක න්යෂ්ටියේ අඩංගු ප්රෝටෝන සංඛ්යාවයි. මෙය ප්රෝටෝන අංකය ලෙසද හඳුන්වනු ලැබේ. එය සාම්ප්රදායිකව නිරූපණය කරනුයේ Z නම් සංකේතයෙනි. රසායනික මුලද්රව්යයක මෙම පරමාණුක ක්රමාංකය එහි පවතින ඉලෙක්ට්රෝන සංඛ්යාවට සමානය.
පරමාණුක ක්රමාංකය සහ ස්කන්ධ ක්රමාංකය අතර ආසන්න සම්බන්ධතාවයක් ඇත. ස්කන්ධ ක්රමාංකය ලෙසින් හදුන්වනුයේ පරමාණුක න්යෂ්ටියේ ඇති ප්රෝටෝන සහ නියුට්රෝනවල එකතුවයි.
ආරම්භයේ දී පරමාණුක ක්රමාංකය භාවිතා කරන ලද්දේ ආවර්තිතා වගුවේ යම් මුලද්රව්යයක් පිහිටිය යුතු ස්ථානය ඇගවීම සදහාය. දිමිත්රි මෙන්ඩලීෆ් විසින් දන්නා මුලද්රව්ය ඒවායේ පරමාණුක භාරය වැඩිවන අනුපිළිවෙලට සකසා සමාන රසායනික ගුණ සහිත මුලද්රව්ය කණ්ඩායම් වලට බෙදන ලදී. කෙසේ වුවත් මුලද්රව්ය ඒවායේ පරමාණුක භාරයන් පදනම් කර ගෙන පමණක් පෙළ ගැස්වීමෙන් නොගැලපීම් කිහිපයක්ම පැන නැගිණි. අයඩීන් හා ටෙලියුලුරියම් ඒවායේ පරමාණුක භාරයන් අනුව පෙළ ගැස් වූ විට යම් නොගැලපීමක් පෙන්නුම් කළ අතර ඒවායේ ස්ථානයන් හුවමාරු කළ විට රසායනික ගුණ අතින් වඩා සුදුසු පිළිවෙලකට පවතින බව පෙන්නුම් කෙරිණි. එබැවින් මුලද්රව්ය ඒවායේ රසායනික ගුණ අතින් ඉතා හොදින් ගැළපෙන අනුපිළිවෙලට සකස් කොට ඒවා ස්ථාන ගත කළ විට වගුව තුළ ඒවා දරන අංකය ඒවායේ පරමාණුක ක්රමාංකය විය. මෙම අංකය පරමාණුවේ ස්කන්ධය සමග බන්ධුතාවයක් පෙන්නුම් කළේය. එහෙත් 1913 දී හෙන්රි ග්වයින්, ජෙෆ්රි මොස්ලි විසින් සිදුකරන ලද පරීක්ෂණවලින් පසුව මෙම මුලද්රව්යයන්ගේ අනුපිළිවෙල පිළිබදව පැන නැගී තිබු විෂමතාවයන්ට අවසානයේ දී පැහැදිලි කිරීමක් සිදුකෙරීය. මුලද්රව්යයන්ගේ X කිරණ විවර්තන වර්ණාවලි අතර දැඩි සම්බන්ධතාවයක් ඇති බව සොයා ගත් මොස්ලි ආවර්තිතා වගුවේ නිවැරදි ස්ථානයන්හි මුලද්රව්ය ස්ථාන ගත කරන ලදී. මුලද්රව්යයක න්යෂ්ටියේ විද්යුත් ආරෝපණය හෙවත් ප්රෝටෝනවල ආරෝපණය එම මුලද්රව්යයන්ගේ පරමාණුක ක්රමාංකයන්ට අනුරූප වන බව මෙයින් නිර්ණය කරන ලදි. පරමාණුක ක්රමාංකය පරමාණුවේ අඩංගු ප්රෝටෝන හෝ ඉලෙක්ට්රෝන සංඛ්යාවට සමාන වේ. තවද ප්රෝටෝන ධන ආරෝපිත වන අතර ඉලෙක්ට්රෝනය සෘණ ආරෝපිතය.
රසායනික ගුණ
[සංස්කරණය]එක් එක් මුලද්රව්යවල න්යෂ්ටියේ අඩංගු ප්රෝටෝන ගණන සැලකිල්ලට ගත් කල ඒවාට විශේෂිත වු රසායනික ගුණ රාශියක් ඇත. ක්වොන්ටම් යාන්ත්ර විද්යාවේ නියමයන් පදනම් කරගනිමින් පරමාණුවක න්යෂ්ටියේ ආරෝපණයෙන් එහි ඉලෙක්ටෝන වින්යාසය පැහැදිලි කළ හැකිය. එක් එක් මුලද්රව්ය ඉලෙක්ට්රෝන කාක්ෂිකවල ආකෘතිය ඒවායේ රසායනික බන්ධන ස්වභාවය තීරණය කරන ප්රධාන සාධක වේ.
නව මුලද්රව්ය
[සංස්කරණය]නව මුලද්රව්ය පිළිබද ගවේෂණය සෑමවිටම විස්තර කරනුයේ ඒවායේ පරමාණුක ක්රමාංකය භාවිතයෙනි. 2007 වසර මුල් කාලය වන විට මෙසේ පරමාණුක ක්රමාංකය 118 (117 බැහැරව) වන තෙක් මුලද්රව්ය සොයා ගෙන ඇත. බැර මුලද්රව්ය පරමාණුක ඉලක්ක කොට ගෙන අයන මගින් ඒවා විචර්ෂණය කිරීමෙන් නව මුලද්රව්ය සංස්ලේෂණය කර ගනී. මෙහිදී ඉලක්ක මුලද්රව්යයෙත් අයන ලෙස භාවිතා කළ මුලද්රව්යයේත් පරමාණුක ක්රමාංකවල ඓක්යය නව සංශ්ලේෂිත මුලද්රව්යයේ පරමාණුක ක්රමාංකයට සමාන වේ. පරමාණුක ක්රමාංකය වැඩිවත්ම පරමාණුවේ අර්ධ ආයු කාලය අඩුවේ.
විකිරණශීලී ක්ෂය වීම
[සංස්කරණය]ඕනෑම මූලද්රව්යයක් අස්ථායි තත්ත්වයකින් යුත් සමස්ථානික එකක් හෝ වැඩි ගණනක් දරණ අතර එම අස්ථායී න්යෂ්ටි සහිත සමස්ථානික අංශු හෝ විද්යුත් චුම්භක තරංග විමෝනය කරමින් විකිරණශීලි ක්ෂය වීමකට භාජනය වේ. න්යෂ්ටියක අතර එහි අඩංගු අංශූන් බැඳ තබා ගන්නේ න්යෂ්ටික ශක්තියෙහි ක්රියාකාරී සීමාව ඉක්මවා ඇත්නම් එවැනි න්යෂ්ටියක් විකිරණශීලි තත්වයට පත් වේ. න්යෂ්ටික බන්ධන ශක්තියේ ක්රියාකාරී පරාසය 1fm ගණය වේ.
විකිරණශීලි සිදුවීම් ප්රධාන ආකාර තුනකට සිදුවිය හැක
ඇල්ෆා ක්ෂයවීම්
[සංස්කරණය]ඇල්ෆා අංශුවක් පිළියම් න්යෂ්ටියක් සේ සැලකිය හැකි අතර එය නියුට්රෝන යුගලයකින් හා ප්රෝටෝන යුගලයකින් සමන්විත වේ. කිසියම් පරමාණුක න්යෂ්ටියක් ඇල්ෆා (x) අංශුවක විමෝචනය කරමින් විකිරණශීලි ක්ෂය වීමට ලක්වන විට ප්රතිඵලය ලෙස ආරම්භක මූලද්රව්යයට වඩා අඩු පරමාණුක ක්රමාංකයක් ඇති මූලද්රව්යයක් ලැබේ.
බීටා ක්ෂය වීම
[සංස්කරණය]බීටා ක්ෂය වීමකදී පිටවන අංශුව බීටා අංශුවක් (β) ලෙස හැදින්වේ. මේවා වර්ග දෙකකි. එනම් ඉලෙක්ට්රෝන හා ප්රෝටෝනයයි. බීටා ක්ෂය වීමකදී සත්ය වශයෙන් අංශු දෙකක් විමෝචන අතර න්යෂ්ටිවල පවතින නියුට්රෝනයක් ප්රෝටෝනයක් බවට හෝ ප්රෝටෝනයක් නියුට්රෝනයක් බවට පත්වීම සිදු වේ. මෙහිදී ප්රෝටෝනයක් නියුට්රෝනයක් බවට පත්වීමේදී පොසිටෝනයක් හා නියුමිනෝවක් න්යෂ්ටියෙන් විමෝචනය වන අතර එවිට ලැබෙන න්යෂ්ටියේ පරමාණුක ක්රමාංකය එකකින් අඩුවේ. නියුට්රෝනයෙන් ප්රෝටෝනයක් බවට පත් වන විට නව න්යෂ්ටියේ පරමාණුක ක්රමාංකය එකකින් අඩුවේ. නියුට්රෝනයේ ප්රෝටෝනයක් බවට පත් වන විට නව න්යෂ්ටියේ පරමාණු ක්රමාංකය එකකින් වැඩි වන අතර එවිට න්යෂ්ටියෙන් ඉලෙක්ට්රෝනයක් හා (ඇන්විනියුට්රිතෝ හෙවත්) ප්රතිනියුටිතෝවක් විමෝචනය වීම සිදුවේ.
ගැමා ක්ෂය වීම්
[සංස්කරණය]පරමාණුක න්යෂ්ටියක් ඉහළ ශක්ති මට්ටමක සිට පහළ ශක්ති මට්ටමකට පැමිණීමේදී සිදුවන අතර එවිට න්යෂ්ටියෙන් විද්යුත් චුම්භක විකිරණ විමෝචනය වේ. ගැමා ක්ෂය වීම සිදුවන්නේ ඇල්ෆා හෝ බීටා ක්ෂය වීමක් නිසා න්යෂ්ටිය උත්තේජන තත්වයට පත්වීමෙනි.
එක් එක් විකිරණශීලි සමස්ථානිකය ක්ෂය වීම කිසියම් නියත රටාවකට සිදුවන අතර එහිදී දෙන ලද සාම්පලයකින් අර්ධයක් ක්ෂය වීමට ගන්නා කාලය දෙන ලද සමස්ථානිකයක් සඳහා නියත අගයක් ගනී. මෙම අගය එම සමස්ථානිකය සදහා අර්ධ ආයු කාලය වේ. මෙම ක්ෂය වීම ඝාතීය ආකාරයක් ගන්නා අතර සෑම අර්ධ ආයු කාලය තුළම එම අර්ධ ආයු කාලය ආරම්භයේ සාම්පලයක් වූ සමස්ථානිකයන් අර්ධයක් බැගින් ක්ෂය වීම සිදු වේ. උදාහරණයක් ලෙස අර්ධ ආයු කාල දෙකකින් අනතුරුව කිසියම් විකිරණශීලි සමස්ථානික සාම්පල අඩංගු එම සමස්ථානික න්යෂ්ටි සංඛ්යාව මුල් අගයේ 25% කි. (1/4)
න්යෂ්ටි සංස්ලේෂණය
[සංස්කරණය]මහා පිපිරුමක් සිදුවීමත් සමගම ස්ථායි ප්රෝටෝන හා ඉලෙක්ට්රෝන ඇති විය. පිපිරුමෙන් පසු ඊළග විනාඩි තුන ඇතුළත විශ්වයේ ඇති හයිඩ්රජන් ලිතියම් හා ඩියුටීරියම් පරමාණු බොහෝමයක් සංස්ලේෂණය විය. මහා පිපුරුමෙන් අවුරුදු 380000 කට පසු ප්රතිසම්බන්ධනය නමින් හැදින් වූ යුගයක දී මුල්ම පරමාණු (බැඳුණු ඉලෙක්ට්රෝන සහිත) සෛද්ධාන්තිකව නිර්මාණය ප්රසාරණය වෙමින් පැවති විශ්වය ඉලෙක්ට්රෝන න්යෂ්ටිවලට බැදීමට හැකිවන තරමට සිසිල් වූයේ මෙම යුගයේදී ය. එතැන් සිට තාරකා තුළ දී පරමාණුක න්යෂ්ටි එකතු වී න්යෂ්ටික විලයනය තුළින් යකඩ දක්වා වූ මුලද්රව්ය නිර්මාණය විය.
ලිතියම් 6 වැනි සමස්ථානික අභ්යවකාශයේ දී කොස්මික් කිරණ පැතිර වීසම මඟින් නිර්මාණය විය. මෙය සිදුවන්නේ අධි ශක්ති ප්රෝටෝනයක් පරමාණුක න්යෂ්ටියකට පහර දී නියුක්ලියෝන විශාල සංඛ්යාවක් මුදා හැරීමෙනි. යකඩ වලට වඩා බර මුලද්රව්ය සුපර් නෝවා තරු තුළ r - ක්රමය මගින් නිෂ්පාදනය වී ඇති අතර AGB තරු තුළ s - ක්රමයෙන් ද නිර්මාණය වී ඇත. මෙම ක්රම දෙකේදීම සිදුවන්නේ පරමාණුක න්යෂ්ටි මගින් නියුට්රෝන ග්රහණය කිරීමයි. ඊයම් වැනි මුලද්රව්ය විශාල ක්ෂයවීම්වලට භාජනය වීමෙනි.
සටහන්
[සංස්කරණය]- ^ බොහෝ සමස්ථානිකයන් ඉලෙක්ට්රෝනයන්ට වඩා නියුක්ලියෝන සහිත වෙති. එක් ඉලෙක්ට්රෝනයක් හා එක් ප්රොටෝනයක් සහිත හයිඩ්රජන්-1 පිළිබඳවදී, ප්රෝටෝනය, සම්පූර්ණ පරමාණුක ස්කන්ධයෙන් , හෝ 99.95% වෙයි.
ආශ්රිත
[සංස්කරණය]- ^ ලෙයිග්, ජී. ජේ., ed. (1990). ඉන්ටනැෂනල් යූනියන් ඔෆ් පියෝ ඇන්ඩ් ඇප්ලයිඩ් කෙමිස්ට්රි, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry – Recommendations 1990. Oxford: Blackwell Scientific Publications. p. 35. ISBN 0-08-022369-9.
An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements.
- ^ ලිඩ්ඩෙල්, හෙන්රි ජෝර්ජ්; ස්කොට්, රොබට්. "අ ග්රීක්-ඉංග්ලිෂ් ලෙක්සිකෝන්". පර්සියස් ඩිජිටල් ලයිබ්රරි.
{{cite web}}: CS1 maint: multiple names: authors list (link) - ^ ලිඩ්ඩෙල්, හෙන්රි ජෝර්ජ්; ස්කොට්, රොබට්. "ἄτομος". අ ග්රීක්-ඉංග්ලිෂ් ලෙක්සිකෝන්. පර්සියස් ඩිජිටල් ලයිබ්රරි. සම්ප්රවේශය 2010-06-21.
{{cite web}}: CS1 maint: multiple names: authors list (link) - ^ හවුබෝල්ඩ්, හෑන්ස්; මාතායි, ඒ.එම්. (1998). "මයික්රොකොස්මොස්: ෆ්රොම් ලෙයුකිපුස් ටු යුකාවා". ස්ට්රක්චඔෆ් දි යුනිවර්ස්. සම්ප්රවේශය 2008-01-17.
- ^ Harrison 2003, පිටු අංක: 123–139.
- ^ "රේඩියෝඇක්ටිව් ඩිකේස්". ස්ටැන්ෆර්ඩ් ලීනියර් ඇක්සලරේටර් සෙන්ටර්. 15 ජූනි 2009. සම්ප්රවේශය 2009-07-04.
ග්රන්ථ ආශ්රිත
[සංස්කරණය]- ලනුන්සියාටා, මයිකල් එෆ්. (2003). හෑන්ඩ්බුක් ඔෆ් රේඩියෝඇක්ටිවිටි ඇනෑලිසිස්. ඇකඩමික් ප්රෙස්. ISBN 0-12-436603-1. OCLC 162129551.
- බෙයර්, එච්. එෆ්. (2003). ඉන්ට්රඩක්ෂන් ටු ද පිසික්ස් ඔෆ් හයිලි චාර්ජ්ඩ් අයන්ස්. සීආර්සී ප්රෙස්. ISBN 0-7503-0481-2. OCLC 47150433.
{{cite book}}: Invalid|ref=harv(help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - චොපින්, ග්රෙගරි ආර්. (2001). රේඩියෝකෙමිස්ට්රි ඇන්ඩ් නියුක්ලිය කෙමිස්ට්රි. එල්සේවිය. ISBN 0-7506-7463-6. OCLC 162592180.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ඩෝල්ටන්, ජේ. (1808). අ නිව් සිස්ටම් ඔෆ් කෙමිකල් පිලෝසොෆි, පළමුකොටස. ලන්ඩන් සහ මැන්චෙස්ටර්: එස්. රසෙල්.
{{cite book}}: Invalid|ref=harv(help) - ඩෙම්ට්රෝඩර්, ෆුල්ෆ්ගැන් (2002). ඇටම්ස්, මොලිකියුල්ස් ඇන්ඩ් ෆෝටෝන්ස්: ඇන් ඉන්ට්රඩක්ෂන් ටු ඇටමික්- මොලිකියුල- ඇන්ඩ් ක්වන්ටම් ෆිසික්ස් (1වන ed.). ස්ප්රිංගර්. ISBN 3-540-20631-0. OCLC 181435713.
{{cite book}}: Invalid|ref=harv(help) - ෆෙයින්මන්, රිචඩ් (1995). සික්ස් ඊසි පීසස්. ද පෙන්ගුයින් ගෲප්. ISBN 978-0-14-027666-4. OCLC 40499574.
- ෆවුල්ස්, ග්රාන්ට් ආර්. (1989). ඉන්ට්රඩක්ෂන් ටු මොඩර්න් ඔප්ටික්ස්. කූරියර් ඩෝවර් ප්රකාශන. ISBN 0-486-65957-7. OCLC 18834711.
- ගංගෝපධ්යාය, ම්රීනාකාන්ති (1981). ඉන්ඩියන් ඇටමිසම්: හිස්ට්රි ඇන්ඩ් සෝසර්ස්. ඇට්ලෑන්ටික් හයිලන්ඩ්ස්, නිව් ජර්සි: හියුමනෑටිස් ප්රෙස්. ISBN 0-391-02177-X. OCLC 10916778.
- ගුඩ්ස්ටේයින්, ඩේවිඩ් එල්. (2002). ස්ටේට්ස් ඔෆ් මැටර්. කූරියර් ඩෝවර් ප්රනාශන. ISBN 0-13-843557-X.
{{cite book}}: Invalid|ref=harv(help) - හැරිසන්, එඩ්යඩ් රොබට් (2003). මාස්ක්ස් ඔෆ් දි යුන්වර්ස්: චේන්ජිං අයිඩියාස් ඔය් ද නේචර් ඔෆ් ද කොස්මොස්. කේම්බ්රිජ් විශ්වවිද්යාල මුද්රණාලය. ISBN 0-521-77351-2. OCLC 50441595.
{{cite book}}: Invalid|ref=harv(help) - ඉයනොන්, ඒ. පැබ්ලෝ (2001). ඩික්ෂනරි ඔෆ් වර්ල්ඩ් ෆිලෝසොෆි. රවුට්ලෙජ්. ISBN 0-415-17995-5. OCLC 44541769.
- Jevremovic, Tatjana (2005). Nuclear Principles in Engineering. Springer. ISBN 0-387-23284-2. OCLC 228384008.
{{cite book}}: Invalid|ref=harv(help) - King, Richard (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. Edinburgh University Press. ISBN 0-7486-0954-7.
{{cite book}}: Invalid|ref=harv(help) - Lequeux, James (2005). The Interstellar Medium. Springer. ISBN 3-540-21326-0. OCLC 133157789.
- Levere, Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. The Johns Hopkins University Press. ISBN 0-8018-6610-3.
{{cite book}}: Invalid|ref=harv(help)CS1 maint: multiple names: authors list (link) - Liang, Z.-P.; Haacke, E. M. (1999). Webster, J. G. (ed.). Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging (PDF). Vol. vol. 2. John Wiley & Sons. pp. 412–26. ISBN 0-471-13946-7. සම්ප්රවේශය 2008-01-09.
{{cite book}}:|volume=has extra text (help); Invalid|ref=harv(help) - McEvilley, Thomas (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. Allworth Press. ISBN 1-58115-203-5.
{{cite book}}: Invalid|ref=harv(help) - MacGregor, Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. ISBN 0-19-521833-7. OCLC 223372888.
{{cite book}}: Invalid|ref=harv(help) - Manuel, Oliver (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 0-306-46562-0. OCLC 228374906.
{{cite book}}: Invalid|ref=harv(help) - Mazo, Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. ISBN 0-19-851567-7. OCLC 48753074.
{{cite book}}: Invalid|ref=harv(help) - Mills, Ian (1993). Quantities, Units and Symbols in Physical Chemistry (2nd ed.). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. ISBN 0-632-03583-8. OCLC 27011505.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - Moran, Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. Harvard University Press. ISBN 0-674-01495-2.
{{cite book}}: Invalid|ref=harv(help) - Myers, Richard (2003). The Basics of Chemistry. Greenwood Press. ISBN 0-313-31664-3. OCLC 50164580.
{{cite book}}: Invalid|ref=harv(help) - Padilla, Michael J. (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey USA: Prentice-Hall, Inc. ISBN 0-13-054091-9. OCLC 47925884.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - Pauling, Linus (1960). The Nature of the Chemical Bond. Cornell University Press. ISBN 0-8014-0333-2. OCLC 17518275.
- Pfeffer, Jeremy I. (2000). Modern Physics: An Introductory Text. Imperial College Press. ISBN 1-86094-250-4. OCLC 45900880.
{{cite book}}: Invalid|ref=harv(help); Unknown parameter|coauthor=ignored (|author=suggested) (help) - Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. CRC Press. ISBN 0-7503-0251-8. OCLC 26853108.
{{cite book}}: Invalid|ref=harv(help) - Roscoe, Henry Enfield (1895). John Dalton and the Rise of Modern Chemistry. Century science series. New York: Macmillan. සම්ප්රවේශය 2011-04-03.
{{cite book}}: Invalid|ref=harv(help) - Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. ISBN 0-19-530573-6.
{{cite book}}: Invalid|ref=harv(help) - Shultis, J. Kenneth; Faw, Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. ISBN 0-8247-0834-2. OCLC 123346507.
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 0-87169-924-9. OCLC 186607849.
{{cite book}}: Invalid|ref=harv(help) - Sills, Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. ISBN 0-7641-2146-4. OCLC 51543743.
{{cite book}}: Invalid|ref=harv(help) - Smirnov, Boris M. (2003). Physics of Atoms and Ions. Springer. ISBN 0-387-95550-X.
{{cite book}}: Invalid|ref=harv(help) - Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster. pp. 213–214. ISBN 0-7432-4379-X.
- Various (2002). Lide, David R. (ed.). Handbook of Chemistry & Physics (88th ed.). CRC. ISBN 0-8493-0486-5. OCLC 179976746. සම්ප්රවේශය 2008-05-23.
{{cite book}}: More than one of|author=and|last=specified (help) - Woan, Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. ISBN 0-521-57507-9. OCLC 224032426.
{{cite book}}: Invalid|ref=harv(help) - Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 0-559-43636-X.
{{cite book}}: Invalid|ref=harv(help) - Zaider, Marco; Rossi, Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. ISBN 0-306-46403-9. OCLC 44110319.
{{cite book}}: Invalid|ref=harv(help) - Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (5th ed.). Houghton Mifflin. ISBN 0-618-34342-3. OCLC 173081482. සම්ප්රවේශය 2008-02-05.
බාහිර සබැඳි
[සංස්කරණය]- Francis, Eden (2002). "Atomic Size". Clackamas Community College. සම්ප්රවේශය 2007-01-09.
- Freudenrich, Craig C. "How Atoms Work". How Stuff Works. සම්ප්රවේශය 2007-01-09.
- "The Atom". Free High School Science Texts: Physics. Wikibooks. සම්ප්රවේශය 2010-07-10.
- Anonymous (2007). "The atom". Science aid+. සම්ප්රවේශය 2010-07-10.—a guide to the atom for teens.
- Anonymous (2006-01-03). "Atoms and Atomic Structure". BBC. සම්ප්රවේශය 2007-01-11.
- Various (2006-01-03). "Physics 2000, Table of Contents". University of Colorado. සම්ප්රවේශය 2008-01-11.
- Various (2006-02-03). "What does an atom look like?". University of Karlsruhe. සම්ප්රවේශය 2008-05-12.

