කාබනික රසායනය

රසායන විද්යාවේ විශේෂිත ම කොටසක් ලෙස කාබනික රසායනය හැදින්වීමට පුළුවන. මුලික වශයෙන් කාබන් හා හයිඩ්රජන් වලින් සමන්විත තවද, නයිට්රජන් , ඔක්සිජන් , හැලජන , පොස්පරස් , සිලිකන් හා සල්පර් වැනි පරමාණු වලින් යුක්ත වී ඇති මෙම සංයෝග වල ව්යුහය , ගුණ , සංයුතිය , ප්රතික්රියා හා පිළියෙළ කිරීම ( සංස්ලේෂණයෙන් හෝ වෙනත් ක්රමයකින්) විද්යාත්මකව අධ්යයනය කිරීම කාබනික රසායන විද්යාවේ දී සිදු කරයි.[1][2][3]
කාබනික රසායනයේ මුල් අර්ථ දැක්වීම , සියලු ක්රියා සෑම විටම කාබනික සංයෝග සමග බැදී පවතී යන දුර්මතය මත ගොඩ නැගුනකි. නමුත් ජීව බලයක් නොයොදාගෙන කාබනික අණු නිෂ්පාදනය කළ හැකියි. තවද පෘථිවියේ ජීවය රදා පවතින්නේ කාබනික රසායනය මතම පමණක් නොවේ. අකාබනික රසායනය ද ඒ සදහා සම්බන්ධ වේ. උදාහරණයක් ලෙස එන්සයිම , යකඩ , [[තඹ]] වැනි ආන්තරික මුලද්රව්ය මත රදා පවතින අතර දත් අස්ථි වැනි දේවල සංයුතිය විමසා බැලූ විට කොටසක් කාබනික වන අතර කොටසක් අකාබනික වෙයි. පරමාණුක කාබන් හැරුණු කොට සමහරක් කාබන් සංයෝග කාණ්ඩ (ඔක්සයිඩ, කාබනේට හා කාබයිඩ් වැනි) පමණක් පොදු සම්මුතියක් ලෙස අකාබනික බවට සලකනු ලැබේ. ජෛව රාසයනය ප්රධාන වශයෙන් ප්රෝටීන , නියුක්ලෙයික් අම්ල හා සීනි වැනි ජෛවාණු පිළිබද වූ ස්වාභාවික රසායනය සමග සබදතා පවත්වයි.
කාබන් පරමාණු වැඩි සංඛ්යාවක් අන්තර්ගත කාබනික සංයෝග ඒවායේ අවේණික ගති ලක්ෂණ නිසා අතිශය විශාල වර්ග හා පරාස වලින් යුත් කාබනික සංයෝග විශාල සංඛ්යාවක් එළි දක්වයි. කාබනික සංයෝග ( තීන්ත , ප්ලාස්ටික්, ආහාර , පුපුරණ ද්රව්යය , ඹෟෂධ , පෙට්ට්රො රසායනික වැනි) බොහෝ අත්යවශ්ය ද්රව්ය රාශියක් පදනම් වී තිබේ. ( විරුද්ධතා කිහිපයක් හැරුණු කොට) පෘථිවිය තුළ සියලු ජීව ක්රියාවල පදනම කාබනික රසායනය ලෙස දැක්විය හැක. කාබනික අණුවල වෙනස් හැඩ හා රසායනික ප්රතික්රියාකාරීත්වය නිසා ජීව දේහ තුළ සිදුවන එන්සයිමය උත්ප්රේරන ආදී ජෛව රසායනික ප්රතික්රියා වැනි යෙදීම් විශ්මය ජනක ප්රමාණයක යෙදීමට හැකිවී ඇත. ජීවිත සම්පුර්ණයෙන්ම පාහේ රදා පවතින්නේ මෙම කාබනික රසායනික සතු සංජනන හැකියාව නිසාය.
කාබනික රසායනයේ වර්තමාන ප්රවණතා (2008) වලට කයිරැල් සින්තසිස් (chiral synthesis) කයිරල් නිෂ්පාදනය, හරිත රසායනය , ක්ෂුද්ර තරංග රසායනය , ෆ්ලරන්ස් හා ක්ෂුද්ර තරංග වර්ණාවලීක්ෂණය ආදී අංශ ඇතුළත්ව ඇත.
ඉතිහාසය
[සංස්කරණය]
19 වන සියවස ආරම්භයේ දී රසායනඥයන් සජීවී පටක තුළ ඇති සංයෝග අජීවී දේ භාවිතයෙන් කෘතිම සංස්ලේෂණය කළ නොහැකි තරම් සංකීර්ණ ව්යුහ වලින් යුක්ත බව සිතූහ. තව ද යම් කිසි ජීව බලයක් ජීවත්වන ප්රාණීන් සතු ලක්ෂණ ප්රදානය කළ බව සිතූහ. ඔවුන් මෙම සංයෝග කාබනික සංයෝග ලෙස නම් කළ අතර වඩා විශ්වාසදායී අකාබනික රසායනය දෙසට ඔවුන්ගේ පරීක්ෂණ නැඹුරු කළහ.
කාබනික රසායනය නව පනක් ලැබුවේ එම සංයෝග සමග ද අකාබනික සංයෝග සමග මෙන්ම ගනුදෙනු කළ හැකි බවත් කිසිදු ජෛව බලයක් නොමැතිව රසායනාගාරයේ දී නිපදවිය හැකි බවත් තේරුම් ගත් විටය. 1816 දී පමණ Michel Chevreul චෙව්රියුල් විසින් විවිධ මේද හා ක්ෂාර යොදාගෙන සාදනු ලැබූ සබන් පිළිබඳ අධ්යයනයක් ආරම්භ කරන ලදී. ඔහු ක්ෂාර සමග ඇති විවිධ අම්ල වෙන්කර සබන් සෑදීය. මේ සියල්ල ස්වාධීන සංයෝග නිසා ඔහුට කිසිදු ජෛව බලයක් නොමැතිව විවිධ මේද ( කාබනික ප්රභව වලින් හටගනීයයි විශ්වාස කරන) රසායනික විපර්යාසයන්ට භාජනය කළ හැකි බව පෙන්වා දිය හැකිවිය. 1828 දී ෆෙඩ්රික් වෝ(හ්)ලර් හට ඇමෝනියම් සයනේට් NH4OCN මගින් කාබනික රසායනිකයන් වූ යූරියා නිෂ්පාදනය කිරීමට හැකිවිය. එය දැන් වෝ(හ්)ලර් සංශ්ලේෂකය ලෙස හඳුන්වනු ලබයි. මෙම සිද්ධියෙන් පසුව ද වෝ(හ්)ලර් තමන් විසින් ජෛව බලය පිළිබද සිද්ධාන්ත බිද හෙලූ බවට ප්රකාශ කිරීමේ දී ප්රවේශම් විය. නමුත් බොහෝ දෙනෙක් මෙම සිද්ධිය කාබනික රසායනයේ සන්ධිස්ථානයක් ලෙස පිළිගත්හ.
කාබනික රසායනයේ ඊළග ප්රධාන පියවර වූයේ 1850 දී විලියම් හෙන්රි පර්තින් විසින් ක්විනීන් නිෂ්පාදනය කිරීමට යාමේ දී වැරදීමකින් කාබනික ඩයි වර්ගයක් නිෂ්පාදනය වීමයි. වර්තමානයේ පර්කින්ගේ ලා දම් පාට ලෙස හදුන්වන්නේ එයයි. එමගින් ඉපයූ විශාල මුදල් සම්භාරය කාබනික රසායනය කෙරෙහි උනන්දුව තවත් වැඩි කරලීය. තවත් පියවරක් වූයේ 1874 දී ඔත්මර් Othmer Zeidler විසින් ඩී.ඩී.ටී. (D.D.T.) පරීක්ෂණාගාරයේ නිපදවීමයි. නමුත්මෙහි කෘමිනාශක ගුණය බොහෝ කලක් යනතුරු සොයාගත නොහැකි විය.
1858 දී ෆෙඩ්රික් ඕගස්ට් කෙකුලේ හා ආර්ච්බල්ඩ් ස්කොට් කූපර් විසින් ස්වාධීනව හා සමගාමීව ගොඩනගන ලද රසායනික ව්යුහ පිළිබඳ සංකල්පය කාබනික රසායන විද්යාවේ සිද්ධාන්තවල තීරණාත්මක සොයා ගැනීමක් විය. චතුර් සංයුජ කාබන් පරමාණු එකිනෙක සමග සංයෝජනය වී කාබනික දැලිස් සෑදෙන බවත් සුදුසු රසායනික ප්රතික්රියා සූක්ෂම ලෙස අර්ථ කරථනය කිරීමෙන් පරමාණුක බන්ධනවල රටා ප්රත්යක්ෂ කරගත හැකි බවත් පෙන්වා දුන්හ.
පෙට්රෝලියම් සොයා ගැනීමත් තාපාංක පරාසවලට අනුව විවිධ කොටස්වලට වෙන් කිරීමත් සමග කාබනික රසායනයේ ඉතිහාසය තවදුරටත් ගලා යන්නට විය. වෙනස් සංයෝග හෝ තනි සංයෝග පරිවර්තනයෙන් පෙට්ට්රෝලියම් කර්මාන්තය මගින් කෘත්රීම රබර්, විවිධ කාබනික මැලියම්, එකිනෙකට වෙනස් ගුණ සහිත පෙට්ට්රෝලියම් නිෂ්පාදන හා ප්ලාස්ටික් වැනි කර්මාන්ත සදහා මග පෑදිනි.
බේයර් විසින් 19 වන සිවයසේ අගභාගයේ ඇසිටයිල් සැලිසිලික් (acetylsalicylic) අම්ලය නිෂ්පාදනය ආරම්භ කිරීමත් සමග ඖෂධ පිළිබඳ රසායනික කර්මාන්ත ආරම්භ විය. මුල් වරට ක්රමානුකූලව වර්ධනය කරන ලද ඖෂධය වූයේ ඇස්ප්රීනමයින් (arsphenamine) ය. පෝල් අ(ර්)ලික් හා ඔහුගේ කණ්ඩායම විසින් ඉතා විෂ සහිත ඇටොක්සිල් (atoxyl) වල ව්යුත්පන්න විශාල සංඛ්යාවක් ක්රමානුකූලව විශ්ලේෂණය කළ අතර වඩාත්ම ඵලදායී හා විෂ සහිත ප්රභේදය නිෂ්පාදනය සඳහා තෝරා ගන්නා ලදී.
පර්කින් විසින් අත්වැරදීමකින් පර්කින්ගේ ලා දම් පාට සොයා ගැනීම වැනි කාබනික රසායනයේ මුල් කාලීන නිදර්ශක සියල්ල අහම්බෙන් සිදු වූ ඒවා විය. නමුත් 20 වන සියවසේ දී ඹෟෂධ නිෂ්පාදනයේ දී මෙන් විශේෂිත ගුණවලින් යුත් අණු සංස්ලේෂණය හා විශේෂිතව තෝරාගත් සංයෝග සංස්ලේෂණය තෙක් කාබනික රසායනය දියුණු විය. දී ඇති සංයෝගයක් සදහා නව සංස්ලේෂණ මාර්ග සොයා ගැනීම පුර්ණ සංස්ලේෂණය ලෙස හැඳින්වේ. යූරියාගෙන් ඇරඹි ස්වාභාවික සංකීර්ණ සංයෝග පූර්ණ සංස්ලේෂණය ග්ලුකෝස් හා ටර්පිනිඔල් (terpineol) සංස්ලේෂණය දක්වා සංකීර්ණ විය. 1907 දී ගුස්ටාන් කොම්ප්පා , කැම්පර් සංස්ලේෂණය මගින් පුර්ණ සංස්ලේෂණය වාණිජකරණය ආරම්භ කරන ලදී. මෙමගින් ඖෂධ නිෂ්පාදනයේ වාසි ද තහවුරු වී තිබේ. උදාහරණ ලෙස කොලෙස්ටරෝල් සම්බන්ද සංයෝග සංකීර්ණ මිනිස් හෝමෝන හා ඒවායේ ව්යුත්පත්නයන් සංස්ලේෂණයට මග පාදා තිබේ. 20 වන සියවස ආරම්භයේ සිට පුර්ණ සංස්ලේෂණය තව තවත් සංකීර්ණ වෙමින් පවතී. ලයිසර්ජික් (lysergic) අම්ලය විටමින් B12 වැනි නිදර්ශන මගින් ඒ බව තහවුරු කරයි.අද දින වන විට ඉලක්ක කරගෙන ඇත්තේ අසමමිතික සංස්ලේෂණය මගින් නිවැරදිව සංස්ලේෂණය කරගත හැකි Stereogenic මධ්යස්ථානයි.
ජෛව රසායනය , සජීවී පටක පිළිබද රසායනය අන්වීක්ෂ කදාවෙහි හා ජීව දේහ තුළ වූ සංකීර්ණ ව්යුහ හා ඒවායේ අන්තර් ක්රියාකාරීත්වය ගැන සෙවීම ආරම්භ වූයේ 20 වන සියවසේ දීය. මෙය අතිමහත් විෂය පථයකින් යුත් කාබනික රසායනයේ නව පරිච්ඡේදයක ආරම්භයයි.
කාබනික ද්රව්ය වර්ගීකරණය
[සංස්කරණය]කාබනික සංයෝග සාමාන්යයෙන් සහසංයුජව බැඳී ඇත. දිගු කාබනික දාම සහ වළලු වැනි අද්විතීය ව්යුහයකට මෙය ඉඩ සලසයි. කාබන් අද්වීතිය ව්යුහයක් සැකසීමට දක්ෂ වීමට සහ කාබනික සංයෝග බොහෝ තිබීමට හේතුව වන්නේ කාබනික පරමාණු එකිනෙක සමග ඉතා ස්ථිර සහ සංයුජ බැඳීම් ඇති කරන නිසාය(ධන අයන සෑදීම). අකාබනික මූලද්රව්ය මෙන් නොව කාබනික මූලද්රව්ය සාමාන්යයෙන් දියවීම, වාෂ්ප කිරීම, ගිනිතැබීම හෝ වියෝජනය 3000C ට අඩු උෂ්ණත්වයකදී සිදු කළ හැකිය. අයන කාබනික සංයෝග පහළ අණුකභාරය සහිත මධ්යසාර සහ හයිඩ්රජන් බන්ධන සිදුවන කාබොක්සිලික් අම්ලය යන විශේෂතා හැරුණු විට අකාබනික ලවණ වලට සමාන කළ විට උදාසීන කාබනික සංයෝග ජලයෙහි අඩුවෙන් දිය වේ.
කාබනික සංයෝග කාබනික ද්රාවකවල පහසුවෙන් දිය වේ. කාබනික ද්රාවක යනු ඊතර් හෝ ඊතයිල් ඇල්කොහොල් වැනි ශුද්ධ සංයෝග හෝ ඛණිජ ඊතර හා සුදු ස්ප්රීතු වැනි ද්රාවණ ආදි වූ මිශ්රණ හෝ භෞතික වියෝජනයේ දී හෝ රසායනික පරිවර්තනවලදී ඛණිජ තෙල්වලින් හෝ තාර කොටස්වලින් ලබා ගනු ලබන නොයෙකුත් ආකාරයේ ශුද්ධ හෝ මිශ්ර සගන්ධ ද්රාවක වේ. නොයෙකුත් ද්රාවකවල ද්රාව්ය ගුණය ද්රාවක වර්ගය සහ ක්රියාකාරී කාණ්ඩ පවත්නේ නම් ඒවා මත බලපැවැත්වේ. ද්රාවණ පිළිබඳ භෞතික රසායන විද්යාව මගින් අධ්යයනය කරනු ලබයි. අකාබනික ලුණු මෙන් කාබනික සංයෝග ද ස්ඵටික සකස් කරයි. කාබනික සංයෝගවල හා කාබන්වල ඇති විශේෂ ලක්ෂණ වන්නේ වෙනත් මූලද්රව්යවල පරමාණූ මගින් එහි සංයුජතාවය ලබා නොගැනීමයි. එසේ නොකළ විට අසංතෘප්ත තත්ත්වයේ පවතී. මෙවැනි අවස්ථාවලදී අප කාබන් කාබන් ද්විත්ව බන්ධන හෝ ත්රිත්ව බන්ධන පිළිබඳව විමසයි. දාමයක ඒක බන්ධන සමග ද්විත්ව බන්ධන මාරුවෙන් මාරුවට පවතින විට සංයුග්මක ද්විත්ව බන්ධන ලෙස හඳුන්වයි. ඇරෝමැටික ව්යුහ යනු මෙවැනි සංයුග්මක දාමයක් වැසුණු වළල්ලක් ලෙස පවතින විශේෂ අවස්ථාවකි.
කාබනික රසායනය විස්තර කිරීම හා නාමකරණය
[සංස්කරණය]වර්ගීකරණයක් සිදු කිරීම සඳහා අදාල සංයෝගය පිළිබඳ සම්පූර්ණ විස්තරයක් අවශ්යය. (රසායනික සංයෝගයෙහි ඇති මූලද්රව්යවල රසායනික සංකේත හා සංයෝගයෙහි ඒ ඒ මුලද්රව්යයේ දී ඇති වාර ගණන ගණනය කිරීමෙන් අකාබනික රසායනික සංයෝග පහසුවෙන් විස්තර කළ හැකි වුවත් කාබනික රසායනයේ දී අණුව තුළ පරමාණුවල සාපේක්ෂ සකස් වීම ද සැලකිල්ලට ගත යුතුය.)
මේ සඳහා යොදාගන්නා එක් ක්රමයක් වන්නේ අණුවෙහි ව්යුහ සූත්රය ඇදීමයි. අණුවල ඇති සංකීර්ණ බව නිසා මේ සදහා පහසු රසායනික අංකන ක්රම බිහි වී තිබේ. මෙහි නවතම ක්රමය රේඛා - කෝණක්රමයයි. මෙමගින් අපැහැදිලිතා ඇති නොවන පරිදි සංයෝග සරළව දැක්වීම සිදු කළ හැකියි. මෙහි දී සෑම රේඛාවකම අවසානයේ හා සන්ධි මගින් කාබන් පරමාණු දැක්වෙන අතර හයිඩ්රජන් පරමාණු අංකනය කිරීම කළ හැකිය. වචනවලින් ප්රකාශ කළ නොහැකි වීම හා මුද්රණය කිරීම අපහසු වීම මෙම ක්රමයේ අවාසි ලෙස ගෙනහැර දැක්විය හැකිය. කාබනික නාමකරණය යොදාගනිමින් අණුක ව්යුහ විස්තර කිරීමෙන් මෙම ගැටළු මග හරවා ගැනීමට හැකිවී ඇත.
අති විශාල ප්රමාණයක් ඇති කාබනික රසායනික සංයෝග හා විශේෂ මගින් ඇතිවන අපහසුතා නිසා කාබනික සංයෝග නම් කිරීම සඳහා වූ අන්තර්ජාතිකව පිළිගත් ක්රමයක අවශ්යතාව රසායනඥයන්ට ප්රභල ලෙස දැනෙන්නට විය. (1892 දී අන්තර් ජාතික රැස්වීම් සමූහයක ප්රතිඵලයක් ලෙස ජිනීවා නාමකරණය බිහිවිය.)
කාබනික සංයෝග හා විශේෂ වර්ධනය වීමත් සමග අදාල ක්රමය පුළුල් කිරීම හා නවීකරණය කිරීම කළ යුතු විය. ශුද්ධ හා ව්යහාරික රසායන විද්යාව පිළිබඳ ජාත්යන්තර සංගමය (IUPAC) විසින් එම කාර්යයේ වගකීම බාර ගන්නා ලදී. කාබනික ව්යුහවල සංකීර්ණතාවය ඉහළ යාමට දායක වන්නේ ජීව රසායනික අංශය බව තේරුම් ගත් ශුද්ධ හා ව්යවහාර රසායන විද්යාව පිළිබද ජාත්යන්තර සංවිධානය (IUPAC) ජීව රසායන විද්යාව හා අණුක ජීව විද්යාව පිළිබඳ ජාත්යන්තර සංවිධානය (IUBMB) සමග එකතුව කාබනික නාමකරණයට අදාල නිර්දේශ සෙවීමට පටන් ගන්නා ලදී.
පසුව කාබනික සංයෝග ගණන හා සංකීර්ණතාව ඉහලයත්ම ශුද්ධ හා ව්යවහාරික රසායන විද්යාව පිළිබඳ ජාත්යන්තර සංවිධානය (IUPAC) ඒවා සරළ කිරීමට නව නිර්දේශ හඳුන්වා දෙන ලදී. එහි පළමු නිර්දේශය වූයේ 1952 දී චක්රීය බෙන්සීන් ව්යුහය සයික්ලොප්හේන් (cyclophane) ලෙස නම් කිරීමයි. පසුව මෙම නිර්දේශ විෂම චක්රීය ව්යුහ ඇතුළුව අනෙකුත් සංකීර්ණ චක්රීය සංයෝග සරළව දැක්වීම තෙක් පුළුල් වූ අතර එවැනි චක්රීය ව්යුහ ප්හේන්ස් (phanes) ලෙස හැඳින්විනි.
සංයෝගයකට විස්තරාත්මක අර්ථ දැක්වීමක් ලබා දීමට අවශ්ය විට දී හෝ IUPAC නාමය සරළ වන විට දී (එනම් එතනෝල් හා එතිල් ඇල්කොහොල්) හැර සාමාන්ය භාවිතවලදී වෙහසෙකාරී වූ විස්තරවලින් වැළකීම සඳහා IUPAC නාමය භාවිතා නොවේ. එවන් අවස්ථාවල දී සංයෝගයේ සාමාන්ය නම හෝ සංයෝගයේ ප්රභවයෙන් බිදී ආ සරළ නම් භාවිතයට ගනී.
සාරාංශයක් ලෙස කාබනික සංයෝග වර්ගීකරණයේ දී සිදු කරන්නේ ඒවායේ අණුක ව්යුහ සකස් වීමට හා අනෙකුත් පරමාණු ප්රධාන අවයව සමග සකස් වී ඇති ආකාරය අනුවය. තවද ව්යුහ සූත්රවලදී ශාඛා , අනෙකුත් මූලද්රව්ය හා / හෝ බහු බන්ධන සැලකීමෙන් පසු ඉතිරිවන සුදුසු කාබන් පරමාණුවල සියලු නිදහස් සංයුජතා හයිඩ්රජන් පරමාණු අත්පත් කරගන්නා බව හැගවේ යයි උපකල්පනය කර ඇත.
හයිඩ්රොකාබන සහ ක්රියාකාරී කාණ්ඩ
[සංස්කරණය]
හයිඩ්රොකාබන යනු කාබන් හා හයිඩ්රජන් පමණක් අඩංගු සංයෝග වේ. වර්ගීකරණය බොහෝ විට ආරම්භ වන්නේ හයිඩ්රොකාබන වලිනි. අනෙකුත් මූලද්රව්ය ඒවායේ පරමාණුක ආකෘති (ක්රියාකාරී කාණ්ඩ) මගින් පෙනී සිටින අතර, එමගින් සංයෝගයට රසායනිකව හා භෞතිකව තීරණාත්මක බලපෑම් ඇති වේ. එබැවින්,ඒ හා සමාන පරමාණුක සැකැස්මක් සහිත සංයෝගවලට ඒ හා සමාන ලක්ෂණ ඇත. මෙම ලක්ෂණ,
- ජලය සමග දක්වන ප්රතික්රියාව
- ආම්ලික / ක්ෂාරීයතාව
- රසායනික ප්රතික්රියා
- ඔක්සිකරණය
ආදියයි.
ඇතැම් ක්රියාකාරී කාණ්ඩ, අකාබනික රසායනයේ එන ක්රියාකාරී කාණ්ඩවලට සමාන වේ. ඒවා ධ්රැවීය පරමාණුක ආකෘති වන අතර, පරමාණුක ඛණ්ඩක ද වේ. මේවා රසායනික ප්රතික්රියාවල දී එක් රසායනික සංයෝගයකින් තවත් එකකට නොවෙනස්ව පවතී.
ක්රියාකාරී කාණ්ඩවල ඇතැම් මූලද්රව්ය (O, S, N, හැලජන) ආදිය තනිවම පැවතිය හැකි අතර, කාණ්ඩයේ නාමය අත්යාවශ්ය නොවේ. නමුත්, මේවා ක්රියාකාරී කාණ්ඩ ලෙසින් සම්බන්ධව සිටින විට හයිඩ්රොකාබනවල ලක්ෂණ වෙනස් කිරීම නිසා ඔවුන්ගේ විශේෂිත ආචරණ හයිඩ්රොකාබන වර්ගීකරණයට හා ලාක්ෂණීකරණයට අනර්ග සහයක් ලබා දෙයි.
පහත දැක්වෙන හයිඩ්රොකාබන වර්ග සලකා බැලූ විට, ඇලිෆැටික සංයෝගවල අඩංගු වන ක්රියාකාරී කාණ්ඩ හැර අනෙක්වා බොහොමයක් ඇරෝමැටික හා ඇලි චක්රීය කාණ්ඩයේ සංයෝගවල අඩංගු වේ. (විජලනය වූ විට හැර) මෙය ප්රතික්රියාකාරිත්වය අඩු කාණ්ඩයකට මග පාදයි.
කාබනික සංයෝග නාමකරණය පිළිබඳ සලකා බැලීමේ දී , විවිධ ක්රියාකාරී කාණ්ඩ අන්තර්ගත වන පිළිවෙලට අංක යොදමින් නාමකරණය කරයි. මේවා ඇතැම් විට IUPAC නීති රීතිවලට අනුකූල වන අතර, ඇතැමෙක් සාමාන්ය ව්යවහාරයේ එන නම්වලින් නාමකරණය කර ඇත. සංයෝග උප කාණ්ඩවලට වර්ග කිරීම ක්රියාකාරී කාණ්ඩ 1කට වඩා ඇති විට බොහෝ අපහසු වේ.
ප්රධාන වර්ගීකරණ දාමයන් 2ක් පවතී.
- විවෘත ඇලිෆැටික දාම සංයෝග
- සංවෘත චක්රීය දාම සංයෝග
විවෘත දාම හා චක්රීය කාණ්ඩ යන දෙකම අඩංගු සංයෝග නාමකරණයට ගනු ලැබූයේ මෑත කාලයේ දීය.
ඇලිෆැටික සංයෝග
[සංස්කරණය]ඇලිෆැටික හයිඩ්රොකාබන කාණ්ඩ 3කට උප වශයෙන් බෙදා ඇත. එසේ බෙදා ඇත්තේ එම සදෘශ ශ්රේණියේ සංයෝග සංතෘප්ත වීම අනුවය.
- ඇල්කේන - ද්විත්ව / ත්රිත්ව බන්ධන අඩංගු නොවන සංයෝග
- ඇල්කීන - ද්විත්ව බන්ධන අඩංගු වන සංයෝග (මෙහිදී ද්විත්ව බන්ධන කිහිපයක් පවා තිබිය හැක)
- ඇල්කයින - ත්රිත්ව බන්ධන අඩංගු වන සංයෝග
අනෙකුත් සංයෝග සියල්ල ඒවායේ ක්රියාකාරී කාණ්ඩය අනුව වර්ග කර ඇත.
ඇලිෆැටික සංයෝග දිගු දාම හෝ ශාඛා දාම සංයෝග වශයෙන් ද, ජ්යාමිතික සමාවයවිකතාව පෙන්වන සංයෝග වශයෙන් ද පැවතිය හැක. මෙය සංයෝගයේ ඔක්ටේන් අංකය වැනි ලක්ෂණවලට බලපායි.
ඇරොමැටික හා ඇලිචක්රීය සංයෝග
[සංස්කරණය]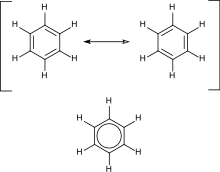
චක්රීය සංයෝග සංතෘප්ත හෝ අසංතෘප්ත විය හැක. මෙහිදී කාබන් බන්ධනයේ දිශානතිය අනුව ස්ථායීම වින්යාසය කාබන් පරමාණු 6ක් පවත්වා ගැනීම වුව ද, කාබන් පරමාණු 5ක් තිබීම ද බහුලව දැකගත හැක. චක්රීය හයිඩ්රොකාබන ඇලි චක්රීය හා ඇරොමැටික (ඇරින) ලෙස කොටස් 2කට බෙදිය හැක.
ඇලි චක්රීය සංයෝග සලකා බලන විට, සයික්ලො ඇල්කේන (cycloalkane) වල බහු බන්ධන නොපවතින අතර, සයික්ලො ඇල්කීන හා සයික්ලෝ ඇල්කයිනවල පවතී. මේ ආකාරය පවතිනුයේ මැක්රොසයික්ල්ස් (macrocycles) නමින් හැඳින්වෙන විශාල දාමවලය. මෙහි සරලම සාමාජිකයා වනුයේ සයික්ලො ප්රොපේන්ය.
ඇරෝමැටික හයිඩ්රොකාබනවල පවතිනුයේ සංයුග්මක ද්විත්ව බන්ධන වේ.(උදා - බෙන්සීන්) මෙහි ව්යුහය යෝජනා කරන ලද්දේ කෙක්යුලේ විසිනි. ඔහු සම්ප්රයුක්තතා මූලධර්මය පළමුව යෝජනා කරන ලද පුද්ගලයා විය. සාම්ප්රදායික චක්රීය සංයෝග සඳහා ඇරොමැටිකභාවය ප්රදානය කරනු විස්ථානගත 4n + 2 ක්වූ ෆයි ඉලෙක්ට්රෝන විසිනි. මෙහි n යනු පූර්ණ සංඛ්යාවකි. මෙහි දී අස්ථායීතාව සිදු වනුයේ 4n වූ සංයුග්මක ෆයි ඉලෙක්ට්රෝන මගිණි.
චක්රීය හයිඩ්රොකාබනවල ලක්ෂණ , විෂමජාතී පරමාණු ඇති විට නැවතත් වෙනස් වේ. ඒවාට පැවතිය හැක්කේ වළල්ලට බාහිරව ඇඳුණු ආදේශකයක් ලෙස හෝ, වළල්ලේ සාමාජිකයෙක් ලෙස පමණි. (එන්ඩොසයික්ලික්- endocyclic). මෙහිදී වළල්ල විෂම චක්රයක් ලෙස හඳුන්වයි. උදා - පිරිඩීන්, ෆුරන් - ඇරෝමැටික විෂම චක්ර ටෙට්රාහයිඩ්රොෆුරන් , පිපෙරිඩීන් - ඇල්චක්රීය විෂම චක්ර
- මෙහි ආදේශිත පරමාණුව ඔක්සිජන් , නයිට්රජන් හෝ සල්ෆර් වේ.
එක් වළල්ලකට අනෙකුත් වළලු සමග එක් වී පොලි චක්රීය සංයෝග සෑදිය හැක. ‘පියුරින්’ යනු පොලි චක්රීය ඇරොමැටික විෂම චක්ර ගණයට අයත් වන්නකි. මෙම වළලුවලින් ඇතැමක එක් පරමාණුවක් (බොහෝවිට කාබන්) එක් වළල්ලකට බන්ධන 2ක් හා තවෙකකට බන්ධන 2ක් වශයෙන් සාදමින් පැවතිය හැක. මෙම සංයෝග “සර්පිල” සංයෝග ලෙස හැඳින්වෙන අතර මේවා ස්වාභාවික නිෂ්පාදන ගණනාවකට වැදගත්වේ.
පොලිමර (Polymers/ බහු අවයව)
[සංස්කරණය]
කාබනික රසායනයේ දී කාබන්හි එක් වැදගත් ලක්ෂණයක් වන්නේ එයට දාමයක් වශයෙන් පැවතිය හැකි අණු ඇති ඇතැම් සංයෝග සෑදිය හැකි වීමයි. මේ ක්රියාවලිය බහු අවයවීකරණය ලෙස හැඳින්වේ. මෙහිදී දිගු දාමය බහු අවයවක වන අතර, තැනුම් ඒකකය ඒක අවයවකය නම් වේ. පොලිමරවල ප්රධාන කාණ්ඩ 2කි.
- කාර්මික බහු අවයවික - කෘතීමව නිපදවන බහු අවයවක[4]
- ජෛව බහු අවයවික - ස්වාභාවික පරිසරයේ ඇති බහු අවයවක
පළමු බහු අවයවකය වන බේක්ලයිට් සොයාගත් පසු, නව නිපදවීම් රාශියක් බිහිවුණි. එවන් පොදුවේ දක්නට ලැබෙන කෘත්රීම කාබනික පොලිමර කීපයක් නම්,
පොලිතීන්/ පොලි එතිලීන්, පොලි ප්රොපිලීන්, නයිට්රෝන්, ටෙෆ්ලෝන් / PTFE , පොලිස්ටයිරීන්, පොලියෙස්ටර්,පොලිමෙතින් මෙතාක්රයිලේට් (පර්ස්පෙක්ස්) , PVC / පොලි වයිනයිල් ක්ලෝරයිඩ්, පොලි අයිසො බියුටිලින්, (මෙය කෘත්රීම රබර් වර්ගයකි. මෙහි තැනුම් ඒකකය butadiene වේ)
ඉහත දැක්වූ උදාහරණ බහු අවයවකවල විවිධ විශේෂයන් වන අතර, ඒවායේ භෞතික ලක්ෂණ එක් එක් විශේෂිත කාර්යයන් සඳහා යොදා ගැනේ. බහු අවයවීකරණයේ දී තත්ව වෙනස් කිරීමෙන් නිෂ්පාදනයේ දී රසායනික සංයෝගයේ දාමදිශා , ශාඛා ප්රමාණය , හා ක්රමවේදයන් අදිය වෙනස් කළ හැක. එක් ඒකකයක් පමණක් යොදාගෙන කරන නිෂ්පාදනය සම බහු අවයවකයක් වේ. තව දුරටත් සලකා බැලූ කළ, වෙනත් ඒකක යෙදු විට එය විෂම පොලිමරයක්/ විෂම බහු අවයවකයක් වේ. එමෙන්ම එහි අඩංගුවන පරමාණු පොකුරේ දිශානතිය පවා පාලනය කළ හැක. නමුත් , දෘඪ බව , ධාරිතාව , කාර්මික ශක්තිය, විනිවිද පෙනෙන සුළු බව , වර්ණය , තාප සන්නායකතාව, උල්ලේඛනය ආදිය වෙනස් කළ හැක්කේ අවසාන ප්රතිඵලයෙන් පමණි.
ජීව අණු
[සංස්කරණය]
ජීවානු රසායනය, කාබනික රසායනයේ ප්රධාන කොටසක් වන අතර, එය බොහෝ විට අධ්යයනය කරනු ලබන්නේ ජීව රසායන විද්යාඥයන් විසිනි. බොහෝමයක් සංකීර්ණ , බහු ක්රියාකාරී කාණ්ඩ අණු ජීව ෙඑන්ද්රියන්ට වැදගත් වේ. ඇතැමක් දිගු දාම ජෛව බහු අවයවක වන අතර එයට ප්රෝටීන, DNA හා RNA හා පොලිසැකරයිඩ (සෙලියුලෝස් වැනි) ආදිය අයත් ව
බකිබෝල්ස් (Bucky balls)
[සංස්කරණය]බක්මිනිස්ටර්ෆුලරන්ස් (Buckminsterfullerenes) නැතහොත් බකිබෝල්ස් යනු කාබනික රසායන විද්යාඥයන් විසින් සොයාගන්නා ලද විශ්මය ජනක අණු සැකැසීම්වලින් එකකි. එහි ගෝලීය ව්යුහය බොහෝ ඉලෙක්ට්රෝනික උපාංග හා කාබන් නැනෝටියුබ් සංක්ෂේපය ඉතා හොඳින් පහදා දෙයි.
බකිබොලයක අණුක ව්යුහය බැලීමට මෙම ගොනුව යොදා ගන්න[[1]]
වෙනත්
[සංස්කරණය]නයිට්රජන්, ඔක්සිජන් හා හැලජන අඩංගු කාබනික බන්ධන සාමාන්යයෙන් වෙන වෙනම කාණ්ඩ නොකරයි. අනෙක්වා ඇතැම්විට කාබනික රසායනයේ ප්රධාන කාණ්වලට ගොණු කරන අතර, ඉන්පසු ඒවා පහත සඳහන් තේමා යටතේ සාකච්ඡා කරයි.
- සල්ෆර් - කාබනික රසායනය
- ලෝහ - කාබනික රසායනය
- පොස්පර්ස් - කාබනික රසායනය
- සිලිකන් - කාබනික රසායනය
කාබනික ද්රව්යවල ලක්ෂණ
[සංස්කරණය]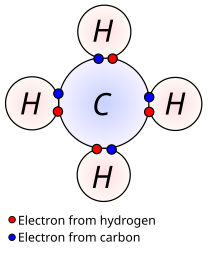
කාබනික සංයෝග සාමාන්යයෙන් සහසංයුජව බැඳී ඇත. දිගු කාබනික දාම සහ වළලු වැනි අද්විතීය ව්යුහයකට මෙය ඉඩ සලසයි. කාබන් අද්වීතිය ව්යුහයක් සැකසීමට දක්ෂ වීමට සහ කාබනික සංයෝග බොහෝ තිබීමට හේතුව වන්නේ කාබනික පරමාණු එකිනෙක සමග ඉතා ස්ථිර සහ සංයුජ බැඳීම් ඇති කරන නිසාය(ධන අයන සෑදීම). අකාබනික මූලද්රව්ය මෙන් නොව කාබනික මූලද්රව්ය සාමාන්යයෙන් දියවීම, වාෂ්ප කිරීම, ගිනිතැබීම හෝ වියෝජනය 3000C ට අඩු උෂ්ණත්වයකදී සිදු කළ හැක. අයන කාබනික සංයෝග පහළ අණුකභාරය සහිත මධ්යසාර සහ හයිඩ්රජන් බන්ධන සිදුවන කාබොක්සිලික් අම්ලය යන විශේෂතා හැරුණු විට අකාබනික ලවණ වලට සමාන කළ විට උදාසීන කාබනික සංයෝග ජලයෙහි අඩුවෙන් දිය වේ.
කාබනික සංයෝග කාබනික ද්රාවකවල පහසුවෙන් දිය වේ. කාබනික ද්රාවක යනු ඊතර් හෝ ඊතයිල් ඇල්කොහොල් වැනි ශුද්ධ සංයෝග හෝ ඛණිජ ඊතර හා සුදු ස්ප්රීතු වැනි ද්රාවණ ආදි වූ මිශ්රණ හෝ භෞතික වියෝජනයේ දී හෝ රසායනික පරිවර්තනවලදී ඛණිජ තෙල්වලින් හෝ තාර කොටස් වලින් ලබා ගනු ලබන නොයෙකුත් ආකාරයේ ශුද්ධ හෝ මිශ්ර සගන්ධ ද්රාවක වේ. නොයෙකුත් ද්රාවකවල ද්රාව්ය ගුණය ද්රාවක වර්ගය සහ ක්රියාකාරී කාණ්ඩ පවත්නේ නම් ඒවා මත බලපැවැත්වේ. ද්රාවණ පිළිබඳ භෞතික රසායන විද්යාව මගින් අධ්යයනය කරනු ලබයි. අකාබනික ලුණු මෙන් කාබනික සංයෝග ද ස්ඵටික සකස් කරයි. කාබනික සංයෝගවල කාබන්වල ඇති විශේෂ ලක්ෂණ වන්නේ වෙනත් මූලද්රව්යවල පරමාණූ මගින් එහි සංයුජතාවය ලබා නොගැනීමයි. එසේ නොකළ විට අසංතෘප්ත තත්වයේ පවතී. මෙවැනි අවස්ථාවලදී අප කාබන් කාබන් ද්විත්ව බන්ධන හෝ ත්රිත්ව බන්ධන පිළිබඳ විමසයි. දාමයක ඒකබන්ධන සමග ද්විත්ව බන්ධන මාරුවෙන් මාරුවට පවතින විට සංයුග්මක ද්විත්ව බන්ධන ලෙස හඳුන්වයි. මෙවැනි සංයුග්මක දාමයක් වැසුණු වළල්ලක් ලෙස පවතින විශේෂ අවස්ථාවකි ඇරෝමැටික ව්යුහය.
අණුක ව්යුහය පැහැදිලි කිරීම
[සංස්කරණය]
කාබනික සංයෝග තුළ , කාබන් පරමාණු , හයිඩ්රජන් පරමාණු හා ක්රියාකාරී කාණ්ඩ අඩංගුය. කාබන්, හයිඩ්රජන් හා සාමාන්යයෙන් ක්රියාකාරී කාණ්ඩවල සංයුජතා පිළිවෙලින් 4, 1 හා 1 වේ. අණුවක වූ කාබන් හා හයිඩ්රජන් පරමාණු ගණන මගින් අසංතෘප්තභාවය නිර්ණය කළ හැක. සියල්ලම නොව බොහෝමයක් ව්යුහයන් සෑම සංයුජතා අංකයකටම එක් බන්ධනයක් තිබීම යන සරළ සංයුජතා නීතිය මගින් අසංතෘප්තභාවය අනුමාන කළ හැක. රසායනික සංයෝගයක් සදහා වූ බොහෝ සමාවයවික පවතින හෙයින් එහි රසායනික සූත්රය පිළිබඳ දැනීම පමණක් ප්රමාණවත් නොවේ. රසායනික සංයෝග මිශ්රණ ලෙස පවතී. කාබනික සංයෝගවල තාපාංක අඩු නිසා හෝ කාබනික ද්රාවණවල පහසුවෙන් දියවන නිසා ආස්රැතය , ස්ඵටීකරණය , වර්ණාලේඛ ශිල්පය වැනි කාබනික රසායනකට අවේනික වූ තාක්ෂණයන් සංශුද්ධ සංඝටකයන්ට මිශ්රණ වෙන් කිරීමේ තාක්ෂණික ක්රමෝපායන් පවතී. රසායනික සංයෝගයක් ව්යුහය අපෝහනය කිරීමේ ක්රම කිහිපයක් පවතී. සාමාන්ය භාවිතයේ පරිදි (ඉංග්රීසි අකාරාදී පිළිවෙලට)
- • ස්ඵටික විද්යාව :- මෙය අණුක ජ්යාමිතිය තීරණය කිරීමේදී සාර්ථක ක්රියාවලියකි. කෙසේ වෙතත් මෙය වඩා පැහැදිලි රූපයක් ලබා ගැනීමට උසස් තත්වයේ හා අවශ්ය ප්රමණයට ස්ඵටික වර්තනයට අපහසුය. එනිසා විශ්ලේෂණයේ දෙවැනි ක්රමයක් ලෙස පවතී. ජෛව රසායන විද්යාවේදී (ප්රෝටීන ආකෘතිය අනුමානයේදී ) සහ අණු සමමිතියක් ඇති ලෝහ - කාබනික ස්ඵටික වර්ගීකරණයේදී ස්ඵටික විද්යාව වඩා දීර්ඝ ලෙස යොදා ගැනේ.
- • මුලද්රව්ය විශ්ලේෂණය :- අණුවක වූ මූලද්රව්ය සංයෝජනය අනුමාන කිරීමේ විච්ඡේදක ක්රියාවලියකි. ස්ක්න්ධ වර්ණාවලිමිතිය
- • අධෝරක්ත වර්ණාවලීක්ෂය :- යම් ක්රියාකාරී කාණ්ඩවල පැවැත්ම සෙවිමට ප්රධාන වශයෙන් භාවිතාවේ .
- • ස්කන්ධ වර්ණාවලීක්ෂ්ය - මෙය සංයෝගයක වූ අණුක භාරය ගණනය කිරීමට යොදාගන්නා අතර ස්කන්ධ වර්ණාවලි විශ්ලේෂණය එහි ව්යුහය අනුමත කිරීමට යොදා ගනී. අධි විභේධක ස්කන්ධ වර්ණාවලිමිතිය මතට සමස්ථානික සකන්ධයන් හා සුලභතාව නිවැරදි සූත්රය හදුනාගත හැක. මෙය සමහර විටදී මූලද්රව්ය වර්ගීකරණය වෙනුවට යොදා ගනී.
- • න්යෂ්ටික චුම්භක සම්ප්රයුක්තතා (NMR) වර්ණාවලිමිතිය :- න්යෂ්ටීන්ගේ රසායනික වටපිටාව හා සාපේක්ෂව එහි වෙනත් න්යෂ්ටීන් හදුනාගනී. මෙය කාබනික රසායන විද්යාඥයන් විසින් ප්රධාන වශයෙන් යොදාගන්නා වැදගත් ක්රමයකි. මෙහිදී පරමාණුවල සන්නායකතාව පිළිබඳ වූ සම්පූර්ණ අභ්යාසයකට අවකාශය ලබා දුන් අතර ත්රිමාණ රසායන විද්යාව මගින් වර්ණාවලීක්ෂය සම්පූර්ණ පරීක්ෂණ කිහිපයක් ලබා දෙන ලදී. ( සම්බන්ධක වර්ණාවලීක්ෂය)
- • ප්රකාශ භ්රමණය :- කයිරැල් සංයෝගයක ප්රතිරූප අවයව දෙකක් අතර වෙනස තල ධ්රැවිත ආලෝකයේ භ්රමණ ලකුණ මගින් දක්වයි. ප්රතිරූප අවයවයක විශේෂිත භ්රමණය දන්නේ නම් සංයෝගයක් ප්රතිරූප අවයව අනුපාතය භ්රමණ විශාලත්වය මගින් ලබා ගත හැක. මෙම තොරතුරු HPCL හා කයිරැල් තීරුවක් මගින්ද සෙවිය හැක.
- • UV /VIS වර්ණාවලීක්ෂය :- පද්ධතියේ සංයුග්මක ප්රමාණය තීරණය කිරීමට භාවිතා කරයි.සමහර විටදී අණු වර්ගීකරණයට භාවිතා කරන අතර UV /VIS බොහෝ විට යොදාගන්නේ දන්නා සංයෝගයක් කොපමණ ප්රමාණයකින් යම් සාම්පලයක්(සාමාන්යයෙන් ද්රව්යයක) තිබේද යන්න දැන ගැනීමටයි.
තවත් ක්රමයන් විශ්ලේෂක රසායන විද්යාවේ ඇත.
කාබනික ප්රතික්රියා
[සංස්කරණය]Organic reactions are chemical reactions involving organic compounds. While pure hydrocarbons undergo certain limited classes of reactions, many more reactions which organic compounds undergo are largely determined by functional groups. The general theory of these reactions involves careful analysis of such properties as the electron affinity of key atoms, bond strengths and steric hindrance. These issues can determine the relative stability of short-lived reactive intermediates, which usually directly determine the path of the reaction.
The basic reaction types are: addition reactions, elimination reactions, substitution reactions, pericyclic reactions, rearrangement reactions and redox reactions. An example of a common reaction is a substitution reaction written as:
- Nu− + C-X → C-Nu + X−
where X is some functional group and Nu is a nucleophile.
The number of possible organic reactions is basically infinite. However, certain general patterns are observed that can be used to describe many common or useful reactions. Each reaction has a stepwise reaction mechanism that explains how it happens in sequence—although the detailed description of steps is not always clear from a list of reactants alone.
The stepwise course of any given reaction mechanism can be represented using arrow pushing techniques in which curved arrows are used to track the movement of electrons as starting materials transition through intermediates to final products.
කාබනික සංශ්ලේෂණය
[සංස්කරණය]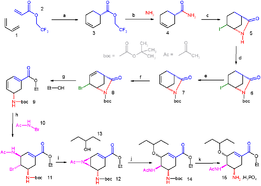
සංස්ලේෂක රසායන විද්යාව , ඉංජිනේරු විද්යාව සමග සම්බන්ධ වන නිසා එය ව්යවහාරික විද්යාවකි. සැලසුම් කිරීම විශ්ලේෂණය සහ / හෝ ප්රායෝගික භාවිත සඳහා නිපදවීම ආදිය එය ඉංජිනේරු විද්යාව හා සම්බන්ධ කිරිමට දායක වේ. නව සංයෝගයක කාබනික සංස්ලේෂණය ගැටළු නිරාකරණ කාර්යයකි. නියමිත අණුවක් සදහා සංස්ලේෂණයක් සැලසුම් කිරීමේදී ප්රශස්ත ප්රතික්රියා හා ආරම්භක ද්රව්ය යොදා ගත යුතුය . සංකීර්ණ අණු සඳහා අදාල අණුව ක්රමානුකූලව තනන ප්රතික්රියා පියවර විශාල සංඛ්යාවක් තිබිය හැක. සංස්ලේෂණය ඉදිරියට ගෙනයනු ලබන්නේ ක්රියාකාරී කාණ්ඩවල ප්රතික්රියාකාරිත්වය භාවිතයට ගනිමිනි. උදාහරණයක් ලෙස කාබොනයිල් සංයෝගයක් ඊනොලේටයක් (enolate) බවට පරිවර්තනය කර නියුක්ලියෝෆයිලයක් ලෙස හෝ නැතහොත් ඉලෙක්ට්රොෆයිලයක් ලෙස භාවිතා කළ හැක. මෙම දෙකෙහි සංයෝජනය ඇල්ඩෝල් ප්රතික්රියාව ලෙස හැඳින්වේ. ප්රායෝගිකව වැදගත් සංස්ලේෂණ සැලසුම් කිරීමේ දී සැමවිටම නියමිත සංස්ලේෂණ විද්යාගාරයේ දී සිදුකිරීම කළ යුතුය. සංකීර්ණ අණු සඳහා නව සංස්ලේෂණ මාර්ග සෑදීමේ විද්යාත්මක ක්රමය පූර්ණ සංස්ලේෂණය ලෙස හැඳින්වේ.
සංස්ලේෂණයක් සැලසුම් කිරීමේ ක්රියා පටිපාටි කිහිපයක් තිබේ. නුතන ක්රමය ප්රතිසංස්ලේෂණයයි. E. J. කුරේ මගින් දියුණු කරන ලද මෙහිදී ඉලක්කගත අණුවෙන් ආරම්භ කර එය දන්නා ප්රතික්රියා භාවිතයෙන් කොටස්වලට වෙන් කිරීම සිදුකරයි. මිළෙන් අඩු සොයාගත හැකි ආරම්භක ද්රව්ය ලැබෙන තෙක් ලැබෙන කොටස්වලට ද පෙර ක්රියාවලියම සිදු කරයි. ඉන්පසු ප්රතිසංස්ලේෂණය ප්රතිවිරුද්ධ දිශාවට යොමු කිරීමෙන් සංස්ලේෂණය ලැබේ. එක් එක් සංයෝග හා ප්රාරම්භක ද්රව්යවලට ඔහු සංස්ලේෂණ ක්රම ඇති බැවින් ‘සංස්ලේෂක ගසක්’ නිර්මාණය කළ හැක.
වැඩිදුර කියැවීම්
[සංස්කරණය]ආශ්රිත
[සංස්කරණය]- ^ Robert T. Morrison, Robert N. Boyd, and Robert K. Boyd, Organic Chemistry, 6th edition (Benjamin Cummings, 1992, ISBN 0-13-643669-2) - this is "Morrison and Boyd", a classic textbook
- ^ John D. Roberts, Marjorie C. Caserio, Basic Principles of Organic Chemistry,(W. A. Benjamin, Inc. ,1964) - another classic textbook
- ^ Richard F. and Sally J. Daley, Organic Chemistry, Online organic chemistry textbook. Ochem4free.info
- ^ "industrial polymers, chemistry of." Encyclopædia Britannica. 2006
- ^ http://www.mathemagic.org/MOBM/buckyballs.html
බාහිර සබැඳි
[සංස්කරණය]- MIT.edu, OpenCourseWare: Organic Chemistry I
- HaverFord.edu, Organic Chemistry Lectures, Videos and Text
- Thime-Connect.com සංරක්ෂණය කළ පිටපත 2008-01-24 at the Wayback Machine, Synlett
- Thieme-Connect.com සංරක්ෂණය කළ පිටපත 2009-01-19 at the Wayback Machine, Synthesis
- Organic-Chemistry.org, Organic Chemistry Portal - Recent Abstracts and (Name)Reactions
- Orgsyn.org, Organic Chemistry synthesis journal
- Ochem4free.info, Home of a full, online, peer-reviewed organic chemistry text
- CEM.MSU.edu, Virtual Textbook of Organic Chemistry
- Organic Chemistry Resources WorldWide - A collection of Links සංරක්ෂණය කළ පිටපත 2015-03-16 at the Wayback Machine
- Thinkquest.org, Organic Families and Their Functional Groups
- Organic.RogerFrost.com, Roger Frost's Organic Chemistry - mechanisms and animation for teaching and learning, typically for ages 15-19
- ChemHelper.com සංරක්ෂණය කළ පිටපත 2020-02-03 at the Wayback Machine, Organic chemistry help
- Organic-Chemistry-Tutor.com සංරක්ෂණය කළ පිටපත 2019-08-01 at the Wayback Machine, Organic Chemistry Tutor
- ACDlabs.com, Chemical Freeware
- Chemaxon.com, Chemical Freeware from ChemAxon.
- AceOrganicChem.com,
- OrgChemInfo.8k.com සංරක්ෂණය කළ පිටපත 2010-06-16 at the Wayback Machine, A collection of Organic chemistry Resources
- Benzylene.com සංරක්ෂණය කළ පිටපත 2009-10-16 at the Wayback Machine, Organic Chemistry Reactions, Mechanisms, and Problems
- Beilstein-Journals.org, Beilstein Journal of Organic Chemistry (Open Access)
- Study-Organic-Chemistry.com, Resources for Success in Organic Chemistry
