ඇනායන
Appearance
(ඇනායනය වෙතින් යළි-යොමු කරන ලදි)
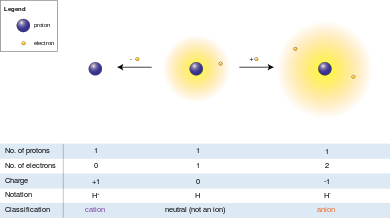
ඇනායන (ඉංග්රීසි: anion) යනු ඉලෙක්ට්රෝන ලබාගෙන ඇති පරමාණු හෝ රැඩිකල් (පරමාණු සමූහ) වේ. දැන් ඒවායේ ප්රෝටෝනවලට වඩා ඉලෙක්ට්රෝන ඇති බැවින් ඇනායන සෘණ ආරෝපණයක් ඇත. උදාහරණ ලෙස, ක්ලෝරයිඩ් Cl-, බ්රෝමයිඩ් Br-, අයඩයිඩ් I- අයන දැක්විය හැකිය. මේවා ඒක සංයුජ ඇනායන වේ, එනම් ඒවාට හයිඩ්රජන් අයනයක් පමණක් සහිත සංයුජතා (සංයුති ධාරිතාව) ඇත. ඒ හා සමානව ද්විසංයුජ ඇනායන යනාදිය ඇත.
අයනයක් යනු විද්යුත් ආරෝපණයක් සහිත පරමාණුවක් (හෝ පරමාණු සමූහයකි). ඇනායන යනු අයන වර්ග දෙකෙන් එකකි. අනෙක් වර්ගය ධන ආරෝපණයක් සහිත කැටායන වේ. බොහෝ ස්ඵටිකවල ඇනායන විශාල වේ; කුඩා කැටායන ඒවා අතර අවකාශයට ගැලපේ.
ඇනායන එසේ හැඳින්වෙන්නේ ඒවා ඇනෝඩය (ධන ඉලෙක්ට්රෝඩය) දෙසට ආකර්ෂණය වන බැවිනි. සියලුම ඇනායන ප්රෝටෝනයක් H+ පිළිගැනීමට නැඹුරු වන බැවින් ඒවා භෂ්ම ලෙස වර්ග කෙරේ.
