කාබන් ඩයොක්සයිඩ්
මෙම ලිපිය විකිපීඩියාවෙහි ගුණාත්මක භාවය පිළිබඳ ප්රමිතිය සපුරාලීම සඳහා ශුද්ධ පවිත්ර කිරීම අවශ්ය විය හැක. |
කාබන් ඩයොක්සයිඩ් යනු ඔක්සිජන් පරමානු දෙකක් කාබන් පරමානුවක් සමග සහසංයුජ බන්ධනයක් මගින් බැඳීමෙන් ඇතිවන රසායනික අනුවකි. සම්මත උෂ්නත්වය හා පීඩනය යටතේ එය වායු අවස්තාවේ පවතී. මෙය වැදගත් හරිතාගාර වායුවක් වන අතර අධෝරක්ත අවශෝෂණය කරන නමුත් දෘෂ්ය ආලෝකය මුදා හරියි. සියලූම ශාක සතුන් දිලීර හා ක්ෂුද්ර ජීවීන් ශ්වසනයේදී කාබන් ඩයොක්සයිඩ් මුදාහරිති. එය ප්රභාසංස්ලේෂණය සඳහා ශාක විසින් යොදා ගනියි. එමනිසා මෙය කාබන් චක්රයේ වැදගත් අංගයකි. ෆොසිල ඉන්ධන දහනයේ අතුරුඵලයක් ලෙස කාබන් ඩයොක්සයිඩ් ඇතිවේ. ගිනිකඳු හා උණුදිය උල්පත් වැනි ප්රභවයන් හරහා ද කාබන් ඩයොක්සයිඩ් ස්වභාවිකව පිටවේ. සෙල්සියස් -78 දී කාබන් ඩයොක්සයිඩ් ඝන තත්වයට පත් වන අතර එය වියළි අයිස් ලෙස හැඳින්වේ. කාබන් ඩයොක්සයිඩ් ආම්ලික ඔක්සයිඩයකි. එය නිල් ලිට්මස් රතු පැහැ ගන්වයි.
මේ වායුව ගැන කෙටියෙන්,
[සංස්කරණය]කෘති වායුගෝලයේ උෂ්ණත්වය ජීවීන්ට ප්රශස්ත මට්ටමකට ගෙන ඒමට මෙන්ම සියලූම ජීවීන්ගේ ආහාර අවශ්යතා සපුරාලීමට හේතුවන ප්රභාශ්වාසලේෂන් ක්රියාවලියේ අමුද්රව්යක් ලෙස ද මෙම වායුව ක්රියා කරයි. වායුගෝලයේ සාමාන්ය සංයුතිය අනුව කාබන් ඩයොක්සයිඩ 0.03% පවතී. නමුත් පොසෙලේ ඉන්ධන දානය නිසා වායුගෝලය කබන්ඩයොක්සයිඩ් ප්රමාණය ඉහල නැගීම ගෝලීය උෂ්ණත්ව වැඩි කිරීමට හේතු වී ඇත.
සාමාන්ය වාතයට වඩා ගණත්වය වැඩි වායුවකි. සාපේක්ෂ අණුක ස්කන්ධය හතලිස් හතරයි. (කාබන්= 18 / එක්සිජන් = 16) [18+16+16 (CO2) = 44] දහනය නොවේ. ජලය සුළු වශයෙන් දියවේ, වර්ණයක් සහ ගන්ධයක් නැත.
රසායනික හා භෞතික ගුණාංග
[සංස්කරණය]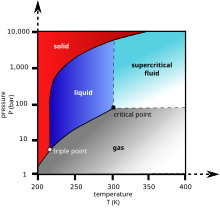
කාබන්ඩයොක්සයිඩ් අවර්ණ අගන්ධ වායුවකි. අධික සාන්ද්රණ සාමාන්ය නොවන වාතාවරණ යටතේ ආශ්වාස කළ විට කටට ඇඹුල් රසක් ද , උගුර හා නාසයට ඇනෙන්නාක් මෙන් සංවේදනයක් දැනිය හැක. මෙවැනි ක්රියා නිසා ශ්ලේෂ්මල පටලය හා ඛේටයෙහි CO2 දියවීමෙන් දුර්වල කාබනික අම්ලයක් සෑදිය හැකිය. මෙම සංවේදනයම කාබනික වන පානයක් භාවිතා කර රාමතෙල් (ගුඩුස්) හරින විට දැනේ. 5000ppm ප්රමාණය ඉක්මවූ විට එය ශරීරයට ඉතා අහිතකර ලෙසත් 5000ppm වැඩි ප්රමාණ (මුළු පරිමාවෙන් 5% පමණ) සත්ව ජීවිත අහිතකර ලෙසත් සලකනු ලැබේ.
සම්මත උෂ්ණත්ව හා පීඩන යටතේ කාබන්ඩයොක්සයිඩ් හි ඝනත්වය 1.98kg/m3 වන අතර එය සාමාන්ය වාතය මෙන් 1.5 පමණ වේ. කාබන්ඩයොක්සයිඩ් අණුව ද්විත්ව බන්ධන දෙකක් සහිත රේඛීය එකකි. එයට විද්යුත් ද්වි ධ්රැවයක් නොමැති අතර සම්පූර්ණයෙන් ඔක්සිකරණය වී ඇති අතර මද පමණින් ක්රියාකාරීය. ගිනි ගන්නා සුළු නොවන අතර මැග්නීසියම් වැනි ලෝහ දහනයට උදව් කරයි.


-78.510C හෝ -109.30F දී කාබන් ඩයොක්සයිඩ් ඝන අවස්ථාවේ සිට වායුමය අවස්ථාවට ඌර්ධවපතනය වේ. එසේත් නැත්නම් වායුමය සිට ඝන අවස්ථාවට ද පත්විය හැක. ඝන කාබන්ඩයොක්සයිඩ් සාමාන්යයෙන් ‘ඩ්රයි අයිස් ’ යන වෙළඳ ලකුණින් භාවිතා කරයි. එය ප්රථම වතාවනට ප්රංශ ජාතික රසායනඥ චාල්ස් තිලෝරියර් විසින් නිරීක්ෂණය කරන ලද “ඩ්රයි අයිස්” ශීතකාරකයක් ලෙස පොදු වශයෙන් භාවිතා කරන අතර එය සාපේක්ෂව මිලෙන් අඩුය. මෙය සතු හොඳ ස්වාභාවික ගුණාංගයක් වනුයේ වායුමය අවස්ථාවට ඌර්ධවපතනය වන විට දියරයක් ඉතිරි නොකිරීමය. එය සිල්ලර බඩු කඩවල , පරීක්ෂණාගාරවල හා නාවික කටයුතුවල දී බහුලව භාවිතා වේ. ශීතකාරක ක්රියාවලට නොමැතිව එය භාවිතා කරන තවත් ක්ෂේත්රයක් නම් blast cleaning ය.
ද්රව කාබන්ඩයොක්සයිඩ් 5.1 වායුගෝල වඩා වැඩි පීඩනවල දී පමණක් සෑදෙන අතර කාබන්ඩයොක්සයිඩ් හි ත්රික ලක්ෂ්යය ආසන්න වශයෙන් 518 kPa , -56.60C දී වෙයි. අවධි ලක්ෂ්යය 7.38 MPa , 31.10C දී වෙයි.
තවත් ඝනරූපී අකාරයක් නම් අස්ඵටික වීදුරු මෙන් ආකාරයක් වන අතර එය සාමාන්ය වායුගෝලය පීඩනයට වඩා වෙනස් තත්වවල ද පවතී. මෙවැනි වීදුරු ‘කාබොනියා’ ලෙස හදුන්වන අතර එය තාපවත් කළ කාබන්ඩයොක්සයිඩ් ඉතා අධික පීඩනයක පවත්වා ගෙන ඇති (40 – 48 GPa හෝ ආසන්න වශයෙන් 400,000 වායුගෝල) දියමන්ති කිණිහිරයක් තුළ අධිශීතනය කිරීමෙනි. කාබන්ඩයොක්සයිඩ් හි වීදුරු සොයාගත් ක්රමවේදයෙන් ඊට සමානව එහි මූලද්රව්ය පවුලේ උදාහරණ සිලිකන් (සිලිකන් වීදුරු) හා ජර්මේනියම් භාවිතයෙන් වීදුරු නිෂ්පාදනය කරයි. කෙසේ වෙතත් කාබොනියා වීදුරු පීඩනය නිදහස් කරත්ම වායුමය අවස්ථාවට පත්වේ.
කාබන්ඩයොක්සයිඩ් වෙන්කර ගැනීම
[සංස්කරණය]කාබන්ඩයොක්සයිඩ් වාතය ආසවනය කිරීමෙන් ලබාගත හැකි වේ. කෙසේ නමුත් මින් ලබා දෙනුයේ ඉතා කුඩා CO2ප්රමාණයක් පමණි. ෙබාහෝ අම්ල හා බොහෝ ලෝහ කාබනේට අතර ප්රතික්රියා වැනි විශාල විවිධත්වයකින් යුතු රසායනික ප්රතික්රියාවලින් කාබන්ඩයොක්සයිඩ් ලබා දෙයි. උදාහරණයක් ලෙස සල්ෆියුරික් අම්ලය හා කැල්සියම් කාබනේට් (හිරිගල් හෝ හුණු) අතර ප්රතික්රියාව පහත විස්තර කර ඇත.
- H2SO4 + CaCO3 → CaSO4 + H2CO3
පසුව H2CO3, ජලය හා CO2 බවට වියෝජනය වෙයි. මෙවැනි ප්රතික්රියාවලදී පෙණ ඇතිවීම හෝ බුබුළු නැගීම හෝ මේ දෙකම පැවතිය හැක. කාර්මිකව මෙවැනි ප්රතික්රියා පුළුල්ව පැතිරීමට හේතුව ඒවා ඉවතලන අම්ල ධාරාවන් උදාසීන කිරීමට යොදා ගත හැකි බැවිණි.
විශාල ලෙස පැතිරුණු ප්රයෝජනවත් නිෂ්පාදනයක් වන පිළිස්සූ හුණු (CaO) රසායන ද්රව්යය , හුණුගල් 8500C පමණ උෂ්ණත්වයකට රත් කිරීමෙන් ලබාගත හැකි අතර මෙම ක්රියාවලියේදී ද CO2 නිපද වේ
- CaCO3 → CaO + CO2
මෙතේන් (ජීව වායුව) , පෙට්රෝලියම් ආස්රැතයන් (ගැසොලීන්,ඩීසල්, ප්රොපේන්, භූමිතෙල්) එසේම ගල් අඟුරු හා දර වැනි සියලුම කාබන් අඩංගු ඉන්ධන දහනයේ දී ද කාබන්ඩයොක්සයිඩ් හා බොහෝ අවස්ථාවල ජලය ද ලබාදෙනු ලබන අතර , උදාහරණයක් ලෙස මෙතේන් හා ඔක්සිජන් අතර රසායනික ප්රතික්රියාව පහත දී ඇත.
- CH4 + 2 O2 → CO2 + 2 H2O
යකඩ, එහි ඔක්සයිඩ ගල් අඟුරු (කෝක්) සමග ධාරා ඌෂ්මකයක ඔක්සිහරණයෙන් , කාබන්ඩයොක්සයිඩ් හා අමු යකඩ නිපද වේ.
- 2 Fe2O3 + 3 C → 4 Fe + 3 CO2
වයින් බියර් හා අනෙකුත් ස්ප්රීතු නිපදවීමේ දී , යීස්ට් මගින් සීනි පරිවෘත්තියට ලක් කිරීමෙන් CO2 හා මධ්යසාර ලෙසට හදුන්වනු ලබන එතනෝල් නිෂ්පාදනය කරයි.
- C6H12O6 → 2 CO2 + 2 C2H5OH
සියලුම ස්වායු ජීවීන්ගේ සෛලවල මයිටොකොන්ඩ්රියා තුළදී කාබෝහයිඩ්රේට , මේද අම්ල හා ප්රෝටීන ඔක්සිකරණය කරන විට CO2 නිපද වේ. මේ හා සම්බන්ධ ප්රතික්රියා විශාල සංඛ්යාවක් ඇතත් ඒවා අධික ලෙස සංකීර්ණ හා පහසුවෙන් විස්තර කළ නොහැකි ඒවාය.යොමුව (සෛලීය ශ්වසනය,නිර්වායු ශ්වසනය, ප්රභාසංස්ලේෂණය) ප්රභාසවයංපෝෂීහු (එනම් ශාක, සයනොබැක්ටීරියා (නීල හරිත ඇල්ගී) වෙනත් ආකාරයක පෝෂණ ක්රමයක් භාවිතා කරති. ශාක වාතයෙන් CO2 අවශෝෂණය කර ජලය සමග ප්රතික්රියාකර කාබෝහයිඩ්රේට නිපදවනු ලැබේ.
- n CO2 + n H2O → (CH2O)n + n O2
CO2 හා H2CO3 (කාබොනික් අම්ලය) අතර ක්ෂණිකව අන්තර් පරිවර්තනය වෙමින් කාබන්ඩයොක්සයිඩ් ජලයේ දියවේ. එහිදී නිපදවෙන CO2 , H2CO3 හා HCO3−(බයිකාබනේට්) හා CO32− (කාබනේට්) වැනි ප්රභේදවල සාපේක්ෂ සාන්ද්රණය pH අගය මත රඳා පවතී. සුළු වශයෙන් ක්ෂාරීය හෝ උදාසීන ජලයේදී (pH > 6.5) වැඩි වශයෙන් (>50%) බයිකාබනේට් පවතින අතර එය මුහුදු ජලයේදී ඉතා සුලභ (> 95% පමණ ) වේ. නමුත් ඉතා ක්ෂාරීය (pH > 10.4) ද්රාවණයකදී සුලභ වශයෙන් (>50%) පවතින්නේ කාබනේටයයි. කාබනේට හා බයිකාබනේට ප්රභේදයන් ජලයේ ඉතා ද්රාව්යය වේ. වාතයත් සමග සමතුලිතතාවයේ පවතින මුහුදු ජලයේ (pH = 8.2 – 8.5 පමණ සුළු වශයෙන් ක්ෂාරීය) ලීටරයකට බයිකාබනේට් 120 mg පමණ පවතියි.
කාබන්ඩයොක්සයිඩ් ප්රධාන වශයෙන් ක්රියාවලි 6කින් නිපදවනු ලැබේ.
- මෙතේන් CO2 බවට පරිවර්තනය කරනු ලබන , ඇමෝනියා හා හයිඩ්රජන් කර්මාන්ත ශාලාවල අතුරු ඵලයක් ලෙස ,
- ෆොසිල ඉන්ධන හා ලී දහනයෙන්,
- බියර්, විස්කි හා අනෙක් මධ්යසාර නිපදවීමේදී හා සීනි පැසවීමේ ක්රියාවලියේ අතුරුඵලයක් ලෙස,
- සෝඩියම් පොස්ෆේට් නිෂ්පාදනයේ අතුරුඵලයක් ලෙස,
- ස්වභාවික කාබන්ඩයොක්සයිඩ්, උල්පත්වලදී, ආම්ලික ජලය, හුණුගල් හෝ ඩොලමයිට් මත ක්රියා කිරීමේ දී ඍජුවම නිපද වේ.
- CaO නිපදවීමේදී සිදුකරන CaCO3 තාපවියෝජනයේදී.
ප්රයෝජන
[සංස්කරණය]
ආහාර , තෙල් හා රසායනික කර්මාන්තවල දී කාබන් ඩයොක්සයිඩ් භාවිතා වේ. එය මිලෙන් අඩු හා ගිනි ගන්නා සුළු නොවන නිසා සම්පීඩන වායු අවශ්යවන බොහෝ ද්රව්යයවල දී එය භාවිතා වේ. කාමර උෂ්ණත්වයේ දී හා ලබා ගත හැකි පීඩනයක් වන බාර් 60ක පීඩනයේ දී කාබන් ඩයොක්සයිඩ් වායු සිට ද්රව කලාපය දක්වා කලාප පරිවර්තනයක් සිදුවන නිසා අඩංගු භාජනය තුළ උපරිම කාබන් ඩයොක්සයිඩ් ප්රමාණයක් අඩංගු කළ හැකිවීම ද තවත් හේතුවකි. ජීවිතාරක්ෂණ ජැකට්ටු තුළ ද සම්පීඩිත කාබන්ඩයොක්සයිඩ් පිරවූ කැනිස්ටර ඇත. තවද ඇලුමිනියම් කැප්සියුල , වායු පිස්තෝල , බයිසිකල් ටයර් හුළං ගැසීමට හා සෙලිරට්සර් නිෂ්පාදනයට අවශ්ය සම්පීඩිත වායු ලබාදීම සදහා විකුණනු ලබයි. ද්රව කාබන් ඩයොක්සයිඩ්හි ක්ෂණික වාෂ්පවීම ගල් අගුරු පතල්වල පිපිරවීම් සදහා භාවිත කෙරේ. අධි සාන්ද්ර කාබන් ඩයොක්සයිඩ් කාවා වැනි කෘමීන් විනාශ කිරීමට ද යොදා ගනී.
කාබන්ඩයොක්සයිඩ් කාබනීකෘත සිසිල් බීම සෑදීමට හා සෝඩා වතුර සෑදීමට යොදා ගනී. බීර හා වයින්වල කාබනීකෘත භාවය ස්වාභාවික පැසවීම තුළින් ලැබුණත් සමහර නිෂ්පාදකයන් ඒවා කෘතීමව කාබනීකරණය සිදු කරයි. 'පොප් රොක්ස්' නමින් හඳුන්වන රස කැවිල්ලක් තුළ 40 බාර් පමණ පීඩනයක් යටතේ ඇති කාබන්ඩයොක්සයිඩ් වායුව ඇති අතර මුඛය තුළ දී එය දියවී වායු බුබුළු පිට කරමින් පොප් හඬක් නගයි.
පිපුම් කාරක කාබන් ඩයොක්සයිඩ් නිෂ්පාදනය කරන අතර එමගින් ඇනූ පිටි ගුලි පිපීම සිදුවේ. බේකරි යීස්ට් සීනි පැසවීම තුළින් පිටි ගුලිය තුළ දී කාබන් ඩයොක්සයිඩ් මුදා හරින අතර බේකින් පවුඩර් , බේකින් සෝඩා වැනි රසායනික පිපුම් කාරක රත් කළ විට හෝ අම්ල හමුවේ කාබන් ඩයොක්සයිඩ් පිටකරයි.

ජංගම පීඩන උපකරණවල වායුමය පද්ධති සටන් රොබොවරු සඳහා වර්තමානයේ දී බහුලවම භාවිතා වන සම්පීඩිත වායුව කාබන්ඩයොක්සයිඩ්ය.
කාබන් ඩයොක්සයිඩ් මගින් ගිනි නිවීම සිදු කළ හැක. විදුලි කාන්දු මගින් සිදුවන ගිනි ගැනීම් නිවීමට සම්පීඩිත ද්රව කාබන්ඩයොක්සයිඩ් අඩංගු ගිනි නිවීම් උපකරණ භාවිතා කරයි. වෙල්ඩින් කිරීමේ පරිසරයක් ලෙසද කාබන් ඩයොක්සයිඩ් භාවිතා කරයි. එහිදී උපකරණ මගින් එමගින් ලෝහ ඔක්සිකරණය කිරීම සිදු කරයි. මෝටර්රථ කර්මාන්තයේ දී කාබන් ඩයොක්සයිඩ් පරිසර යටතේ සිදු කරන පෑස්සුම් වෙනත් නිෂ්ක්රීය තත්ව යටතේ කරන පෑස්සීම්වලට වඩා භංගුරය. එම පෑස්සුම් කාබනික අම්ලය සෑදීම නිසා කාලයත් සමග නරක් වේ. එය පෑස්සුම් වායුවක් ලෙස යොදාගන්නේ ආගන් , හීලියම් වැනි නිෂ්ක්රීය වායු වලට වඩා මිළ අඩු නිසාය.
කාබන් ඩයොක්සයිඩ් බෙහොමයක් ලිපෝෆිල්ක් කාබනික සංයෝග සදහා හොද ද්රාවකයක් වන අතර කෝපි වලින් කැෆේන් ඉවත් කිරීමට යොදා ගනී. පළමුව කොළ කෝපි ඇට වතුරෙන් පොගවා අඩි 70 (21m) උස කුළුණක උඩ තබා කුළුණේ පහළින් 930 C පමණ වූ ද්රව කාබන් ඩයොක්සයිඩ් යවනු ලැබේ. කෝපිවල ඇති කැෆේන් විවිධ කාබන් ඩයොක්සයිඩ් තුළට අවශෝෂණය වේ.
ඖෂධ හා රසායනික කර්මාන්තවල අවධානය කාබන් ඩයොක්සයඩ් දෙසට යොමු වීමට පටන් ගන්නේ කාබනික ක්ලෝරයිඩ් වලට අඩු විෂ සහිත ආදේශකයක් ලෙස ක්රියා කළ හැකි නිසාය. සමහරක් ඩ්රයි ක්ලීනර් කරුවන් මේ හේතුව නිසා කාබන් ඩයොක්සයිඩ් භාවිතා කරයි. (හරිත රසායනය බලන්න)
ශාකවල ප්රභාසංස්ලේෂණය සඳහා කාබන් ඩයොක්සයිඩ් අත්යවශ්යවේ. වර්තමානයේ වායුගෝලයේ කාබන් ඩයොක්සයිඩ් ප්රමාණය ශාකවලට අත්යවශ්ය ප්රමාණයට වඩා මදක් වැඩියෙන් ඇත. එමනිසා හරිතාගාර තුළ ශාක වර්ධනය වේගවත් කිරීමට කාබන් ඩයොක්සයිඩ් වැඩි වායු ගෝලීය තත්ව භාවිතා කරයි. ප්රභාසංස්ලේෂණය සිදු වීමේදී හරිතාගාරය තුළ කාබන් ඩයොක්සයිඩ් සාන්ද්රණය අඩු වී ශාක වලට හානිදායක තත්වයක් ඇති විය හැක. කාබන් ඩයොක්සයිඩ්වල අධික සාන්ද්රණ සත්ව ජීවිත සඳහා විෂ දායකය. 10,000 ppm (1%) සාන්ද්රණයක් පැය කිහිපයක් හරිතාගාරයක් තුළ පවත්වා ගැනීමෙන් එතුළින් සුදු මැස්සන් , මකුළු කීඩෑවන් වැනි කෘමීන් ඉවත් කර ගතහැකි වේ.
බල ශක්ති උත්පාදනයෙන් ලැබෙන කාබන් ඩයොක්සයිඩ් පොකුණු තුළට බුබුළනය කර ඇල්ගී ඉන්පසු එම ඇල්ගී ජෛව ඉන්ධන ලෙස භාවිතා කිරීමට යෝජනා වී ඇත. වෛද්ය විද්යාවේ දී සංශුද්ධ ඔක්සිජන්වලට 5%ක් දක්වා කාබන්ඩයොක්සයිඩ් එකතු කරනු ලැබේ.මෙමගින් හුස්ම ගැනීම අපහසු අවස්ථාවන්හිදී ශ්වසනය උත්තේජනය කර රුධිරයෙහි CO2 හා O2 තුල්යතාව පවත්වා ගනී.
සාමාන්ය කාර්මික ගෑස් ලේසර් වර්ගය කාබන් ඩයොක්සයිඩ් ලේසරයයි.
දොඩම් ලෙළිවල ඇති ලිමොනීන් (limonene) ඔක්සයිඩ් හෝ වෙනත් එපොක්සයිඩ් (epoxide) සමග කාබන් ඩයොක්සයිඩ් බන්ධනය වී බහු අවයවක හෝ ප්ලාස්ටික් සාදයි.
වැඩි දියුණු කළ තෙල් ප්රතිප්රාප්තියේ දී ද කාබන්ඩයොක්යිඩ් යොදා ගනී. එහිදී නිෂ්පාදනය කරන තෙල් ළිං තුළට හෝ ඒ අවටට කාබන් ඩයොක්සයිඩ් ඇතුල් කෙරේ. මෙහිදී කාබන් ඩයොක්සයිඩ් පීඩන කාරකයක් ලෙස ක්රියා කරන අතරම පෙළොව යට ඛනිජ තෙල්වල දියවී ඒවායේ දුස්ස්රාවීතාවය අඩුකර පොළොව තුළින් ඉවතට ගන්නා ළිඳ කරා තෙල් වේගයෙන් ගලායාමට සලස්වයි. විශාල තෙල් බිම්වල කාබන්ඩයොක්සයිඩ් ඇතුල් කරන ස්ථානවලට ප්රවාහනයට වෙනම පයිප්ප ජාලයක් ඇත.
රසායනික කර්මාන්තවල දී යූරියා , බයිකාබනේට හා සෝඩියම් සැලිසිලේට නිෂ්පාදනයට කාබන් ඩයොක්සයිඩ් භාවිතා කෙරේ.
ද්රව හා ඝන කාබන්ඩයොක්සයිඩ් වැදගත් ශීත කාරක වේ. විශේෂයෙන් ආහාර කර්මාන්තයේදී අයිස්ක්රීම් හා මිදුණු කෑම ප්රවාහනයේදී හා ගබඩා කිරීමේදී මේවා වැදගත් වේ. ශීතකරණ උපකරණ භාවිතය ප්රායෝගික නොවන අවස්ථාවල දී 'ඩ්රයි අයිස්' ලෙස හඳුන්වන කාබන් ඩයොක්සයිඩ් භාවිතා කෙරේ.
ද්රව කාබන්ඩයොක්සයිඩ් (කාර්මික නාමකරණය R 744 / R -744) R -12 සොයා ගැනීමට පෙර ශීතකාරකයක් ලෙස භාවිතා කළ අතර පාරිසරික බලපෑම් නිසා නැවත වරක් භාවිතයට පැමිණීමට ඉඩ ඇත. වැඩි පරිමාමිතික සිසිලන ධාරිතාවක් ඇති මෙහි භෞතික ගුණ සිසිලනයට ශීත කරණයට හා රත් කිරීමේ අවශ්යතාවලට යෝග්ය වේ. 130 බාර් දක්වා වූ පීඩනවල ක්රියාකාරී විය හැකි නිසා කාබන් ඩයොක්සයිඩ් පද්ධතිවලට අධිප්රතිරෝධී උපාංග අවශ්ය අතර දැනටමත් බොහෝ කොටස් ඒවා නිපදවා ඇත. රථ වාහනවල සියලු ධාවනත්වවලින් 90% කදීම පාහේ එහි වායු සමීකරණය තුළ R - 134a ට වඩා R 744 කාර්යක්ෂමව ක්රියා කරයි. එහි පාරිසරික වාසි (GWP 1 ක් විට ඕගේන්වලට හානිදායක නොවීම , විෂ සහිත නොවීම , ගිනි නොගැනීම) නිසා දැනට මෝටර්රථ , සුපිරි වෙළඳසැල් , උණුවතුර පයිප්ප වැනි HFC භාවිතා කරන දෑ අනාගතයේ දී කාබන්ඩයොක්සයිඩ් වලින් ප්රතිස්ථාපනය විය හැකිය. කොකා කෝලා ආයතනය කාබන් ඩයොක්සයිඩ් මත පදනම් වූ ශීතකරණ යොදාගන්නා අතර එක්සත් ජනපද හමුදාව කාබන් ඩයොක්සයිඩ් මත පදනම් වී ඇති ශීතකරණ හා උණුසුම් කිරීමේ තාක්ෂණය ගැන උනන්දුවෙන් පසුවෙයි.
2007 වසර අවසානයේ දී ලෝක රථ වාහන කර්මාන්තය ඊළඟ පරම්පරාවේ රථ වාහනවල වායු සමීකරණ සඳහා නව ශීතකාරක වායුවක් තීරණයට බලාපොරොත්තුව ඇත. කාබන් ඩයොක්සයිඩ් ද එහිදී සාකච්ඡාවට බඳුන් වූ විකල්පයකි. (සිසිලන යුද්ධය බලන්න).
ජීව විද්යාත්මක භූමිකාව
[සංස්කරණය]සෛලීය ස්වසනය නම් ක්රියාවලිය ඔස්සේ සිය පරිවෘත්තීය ක්රියාකාරිත්වයේ කොටසක් ලෙස O2 යොදාගෙන සීනි / කාබොහයිඩ්රේට මේද හා ඇමයිනෝ අම්ල බිද හෙලීම මගින් සිය ශක්ති අවශ්යතා සපුරා ගන්නා ජීවීන් මගින් එම ක්රියාවලියේ දී නිපදවන අන්තඵලය කාබන් ඩයොක්සයිඩ් වේ. මෙම ජීවීන් අතර සියළු ශාක හා සතුන් බොහෝ දිලීර සහ සමහරක් බැක්ටීරියා අයත් වේ. වඩාත් උසස් ජීවීන් තුළ ද මෙම CO2 වායුව රුධිර ඔස්සේ පෙනහළු කරා පැමිණ ප්රශ්වාසය ඔස්සේ බැහැර වීම සිදු වේ. ප්රභාසංස්ලේෂණය සිදු කරන විටදී ශාක වායුගෝලයේ CO2 උරාගනී.
ප්රභාසංස්ලේෂණයේ කාර්ය භාරය
[සංස්කරණය]ශාක ප්රභාසංස්ලේෂණය මගින් වායුගෝලයෙන් CO2 ඉවත් කරන අතර එම CO2 ජලය හා එක්කර ආලෝක ශක්තිය යොදාගෙන කාබනික සංයෝග නිපදවීම සිදුකරයි. මෙහිදී ජලය ප්රභාවිච්ඡේදනයෙන් ලැබෙන O2 වායුගෝලයට නිදහස් වන අතර ඉතිරිවන H / හයිඩ්රජන් පරමාණු නැවත ප්රෝටෝන හා ඉලෙක්ට්රෝන ලෙසට වෙන්කොට ප්රභාපොස්පොරසිලීකරණය මගින් රසායනික ශක්තිය නිපදවීමට යොදා ගැනේ. මෙසේ ලබාගන්නා ශක්තිය කැල්වින් වක්රය ඔස්සේ කාබන් තිර කිරීම මගින් කාබොහයිඩ්රේට නිපදවීමට යොදා ගැනේ. මෙසේ නිපදවෙන ඵල නැවත ස්වසනය මගින් ශාක වර්ධනයට යොදාගත හැක.
වාතාශ්රය ලැබෙන විට පවා හරිතාගාර තුළට CO2 ඇතුල් කිරීම ශාක වර්ධනය පවත්වා ගැනීමට අත්යවශ්ය වේ. ඊට හේතුව දිවා කාලයේ දී CO2 සාන්ද්රණය 200ppm දක්වා පහත වැටීමට ඉඩ තිබීමයි. මෙම අගය C3 ශාකවල ප්රභාසංස්ලේෂණය සදහා අවම අගය වේ. හාත්පස තත්වවලට සාපේක්ෂව 1000 ppm CO2 සාන්ද්රණයක් යටතේ ශාක වර්ධන සීඝ්රතාව 50% කින් පමණ ඉහළ යා හැක.
ශාක ස්වායු ස්වසනයේ දී CO2 නිදහස් කිරීමද සිදු කරන බැවින් සමස්ත වශයෙන් CO2 අවශෝෂක ලෙස ක්රියා කරන්නේ වර්ධක අවධියේ දී පමණි. උදාහරණයක් ලෙස ගතහොත් වර්ධක අවධියේ පවතින වනාන්තරයක් වසරකට CO2 ටොන් විශාල ගණනක් අවශෝෂණය කරන අතර පරිණත වනාන්තරයක් එය ජෛව සංස්ලේෂණයේ දී අවශෝෂණය කරන CO2 ප්රමාණයට සමාන ප්රමාණයක් ස්වසනය හා මළ කොටස් දිරාපත් වීම ඔස්සේ ( කඩා වැටුණු අතු වැකි) නිදහස් කරයි. කෙසේ නමුත් පරිණත වනාන්තර පෘථිවි වායුගෝලයේ CO2 සමතුලිතතාව පවත්වා ගැනීම සදහා ඉතා වැදගත් වේ. මීට අමතරව ප්ලවාංග මගින් ප්රභාසංස්ලේෂණය ඔස්සේ ඉහළ සාගර කලාපයේ ද්රවිත CO2 උරා ගැනීමට ඉඩ සැලසීම පෘථිවිය මත ජීවයේ පැවැත්මට අතිශය වැදගත් වේ.
විෂ සහිත ස්වභාවය
[සංස්කරණය]නැටුම් වාතයේ CO2 ප්රමාණය / ප්රතිශතය ස්ථානීය ලක්ෂණ අනුව 0.03% ක් 0.06% එනම් 300ppm - 600 ppm අතර විචලනය වේ.
සාමාන්ය පුද්ගලයෙකුගේ ප්රශ්වාස වාතයේ පරිමාවෙන් 4.5%ක් පමණ CO2 වලින් සමන්විතය.
සාමාන්ය පිරිමින්ට පවා වැඩි CO2 සාන්ද්රණවලට තරමක් දුරට අනුවර්තනය විය හැක. 3% ක CO2 සාන්ද්රණයක් සහිත වාතය දිගින් දිගටම මාසයක කාලයක් ද 4% ක CO2 සාන්ද්රණයක් සහිත වාතය දිගින් දිගටම සතියකට වැඩි කාලයක් ද ආශ්වාසය කිරීම දරාගත හැකි වේ. තවද සංවෘත වායුමය අවකාශ (උදා- සබ්මැරීන) සදහා 2% ක CO2 ප්රතිශතයක් සහිත වාතය යොදා ගත හැකි බවට මත පලවී තිබේ. ඊට හේතුව ඉහත අනුවර්තනය තාවකාලික කායික ප්රතිචාරයක් වීමයි. මෙම සාන්ද්රණයේ දී සාමාන්ය කායික ක්රියාකාරිත්වයෙහි අඩුවීමක් සිදු නොවේ.
මුළු පරිමාවෙන් 5%කට වැඩි ප්රතිශතයක් CO2 සහිත (50000ppm) වාතය ආශ්වාස කිරීම අනතුරුදායක වන අතර දිනකට පැය අටක කාලයක් රැකියාවේ යෙදෙන නිරෝගී වැඩිහිටියන් සඳහා නිර්දේශිත උපරිම ආරක්ෂාකාරී අගය වර්තමානයේ දී 0.5% ක් හෙවත් 5000 ppm වේ. හෘද රෝග ආශ්වාස ප්රශ්වාස අපහසුතා සහිත පුද්ගලයන් මහළු අය සහ ළමුන් සඳහා නිර්දේශිත ආරක්ෂාකාරී උපරිම අගය මීටද බොහෝ අඩු අගයකි.
මෙම අගයයන් සංශුද්ධ CO2 සාන්ද්රණ සඳහා අදාල වේ. පිරිසිදු වායුගෝලීය වාතයට සාපේක්ෂව මිනිසුන්ගෙන් පිරුණු අභ්යන්තර අවකාශයන්හි CO2 සාන්ද්රණය ඉහත අගයන් ඉක්මවා යා හැක. 1000 ppm CO2 සාන්ද්රණයක් යටතේ 20%ක ප්රතිශතයක් වූ පිරිසකට අපහසුතාවන්ට මුහුණ දිය හැකි අතර CO2 සාන්ද්රණය ඉහළ යන විට අපහසුතාව ද වැඩි වේ. නමුත් මෙම අපහසුතාවට හේතුව CO2 නොවන අතර මෙවන් විටෙක අධිකව දහඩිය දැමීම හා ස්වසනය නිසා නිකුත්ව අනෙකුත් වායූන් මෙම අපහසුතාව ඇති කිරීමට හේතු වේ. 2000ppm CO2 සාන්ද්රණයක් යටතේ බහුතරයක් සැලකිය යුතු අපහසුතාවයන්ට මුහුණ පාන අතර වැඩි දෙනෙක් ඕක්කාරය හා හිසරදය වැනි තත්වයන්ගෙන් පීඩාවට පත්වීම සිදු වේ. අභ්යන්තර අවකාශයන්හි වායු තත්ව දර්ශකයන්හිදී 300 ppm සිට 2500 ppm දක්වා වූ මට්ටම් දර්ශක අගයක් සේ භාවිතා කෙරේ.
CO2 විෂවීමේ තත්ව සඳහා පතල්කරුවන් විවිධ නම් භාවිතා කරති. අධික CO2 සාන්ද්රණයක් නිසා හානි සිදුවීම වැළැක්වීමට පතල්කරුවන් පතල් තුළ කූඩු කළ කැනරි කුරුල්ලන් තබා තැනීම සිදු කරති. මිනිසුන්ට අහිතකර CO2 සාන්ද්රණයන්ට සාපේක්ෂව පක්ෂීන්ට අහිතකර සාන්ද්රණයක් වඩාත් අඩු බැවින් මිනිසුන්ට අහිතකර සාන්ද්රණයන්ට CO2 එලැඹීමට පෙර අනිවාර්යයෙන්ම කැනරි කුරුල්ලන් මියයාම සිදු වේ. 1986 වර්ෂයේ කැමරූන්හි “ලේක් නයොස්” හිදී CO2 වායුව ප්රදේශයේ මතුපිට වායුගෝලයේ වූ සැහැල්ලු වායූන් (O2 වැනි) ඉවතට තල්ලු කිරීම නිසා ඉහත සිද්ධියෙන් ජීවිත 2000කට ආසන්න සංඛ්යාවක් අහිමි විය.
කිසියම් අවකාශයක් තුළ CO2 වායුවේ ppm අගය (මිලියනයකට තිබෙන කොටස් ගත්කළ CDPL අගය) එම අවකාශය තුළ වාසය කරන්නන්ට හිසරදය හා නිදිබර ගතිය ඇති කරන හා ක්රියාකාරිත්වය අඩ කරන වායු දූෂක මැනීමට එක්තරා විකල්ප ක්රමයක් ලෙස භාවිතා වේ. ඉහත අහිතකර ප්රතිඵලවලින් මිදීම සඳහා අභ්යන්තර වායු ප්රමිතිය CO2 600 ppm ට අඩු තත්වයක පවත්වාගත යුතු වේ. මෙම CO2 අගයත් CDPL අගයක් ලෙස ප්රකාශ කරනු ලැබේ.NIOSH ට අනුව 1000 ඉක්මවන CDPL අගයයත් ප්රමාණවත් වාතාශ්රය නොලැබීමට පෙන්වන සාධකයකි. CDPL අගය සංවෘත අවකාශයක් තුළ 1000 නොඉක්මවිය යුතු බව ASHRAE නිර්දේශ කරයි. තවද රැකියා ස්ථානවල දිගු කාලීන නිරාවර්ණ තත්ව සඳහා සීමාව CDPL අගය 5000 නොඉක්මවිය යුතු බව OSHA මගින් තීරණය කර ඇත. මේ අතර එක්සත් ජනපදයේ රැකියාව හා බැදුණු ආරක්ෂාව යහපත් සෞඛ්ය පිළිබඳ රාජ්ය ආයතනය මගින් 30000ට වැඩි CDPL අගයක් සහිත අවකාශයන්ට සේවකයන් නිරාවරණය කළ හැකි උපරිම කාලය විනාඩි 10කට සීමා කර තිබෙන අතර 40000ට වැඩි CDPL අගයන් සෞඛ්ය හා ආරක්ෂාවට ක්ෂණික තර්ජන එල්ල කරන තත්ව සේ ප්රකාශයට පත් කර තිබේ. CDPL 50000ක අගයක් යටතේ පැය භාගයක කාලයක් ස්වසනය කිරීම ඉතා දරුණු ප්රතිඵල ගෙන දිය හැකි අතර 70000ත් 100000ත් අතර CDPL අගයන්ට නිරාවරණය වීමෙන් විනාඩි කිහිපයක් තුළ සිහිවිසඤ්ඥ තත්වයට පත්වීමට හේතු වේ. මේ අනුව කාබන් ඩයොක්සයිඩ් වායුමය හෝ (වියළි අයිස්) ඝන තත්ව යටතේ භාවිතා කරන්නේ නම් වාතාශ්රය සහිත තත්ව යටතේ සිදු කළ යුතු වේ.
