කොපර්(I) ක්ලෝරයිඩ්

| |
| Names | |
|---|---|
| IUPAC name
කොපර්(I) chloride
| |
| වෙනත් නාම
Cuprous chloride
| |
| Identifiers | |
| CAS number | 7758-89-6 |
| PubChem | 62652 |
| ChemSpider | 56403 |
| EC number | 231-842-9 |
| ChEBI | CHEBI:53472 |
| RTECS number | GL6990000 |
| SMILES |
|
| InChI |
|
| InChI key |
|
| Properties | |
| Molecular formula | CuCl |
| අණුක ස්කන්ධය | 98.999 g/mol |
| Appearance | white powder, slightly green from oxidized impurities |
| Density | 4.145 g/cm3 |
| Melting point |
426 °C (703 K) |
| Boiling point |
1490 °C (1760 K) (decomp.) |
| Solubility in water | 0.0062 g/100 mL (20 °C) |
| Solubility product, Ksp | 1.72 x 10-7 |
| Solubility | insoluble in ethanol acetone; soluble in concentrated HCl, NH4OH |
| Solubility product, Ksp | 1.930[1] |
| Structure | |
| Crystal structure | Zinc blende structure |
| Hazards | |
| Flash point | {{{value}}} |
| Lethal dose or concentration (LD, LC): | |
LD50 (median dose)
|
140 mg/kg |
| Related compounds | |
| Other anions | කොපර්(I) bromide කොපර්(I) iodide |
| Other cations | කොපර්(II) chloride Silver(I) chloride |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
කොපර් ක්ලෝරයිඩ් පොදුවේ කියුප්රස් ක්ලෝරයිඩ් ලෙසද හඳුන්වයි. මෙය කොපර්වල පහලම ක්ලෝරයිඩය යි. රසායනික සූත්රය CuCl වේ. මෙම ඵලය සුදු පැහැති ඝණයක් වන අතර එය ජලයේ දිය නොවේ. නමුත් මෙය පූර්ණ වශයෙන් සාන්ද්ර HCl වල ද්රාවනය වේ. සංශුද්ධ නොවන කොපර්(I) Chlorideවල කොපර්(II) Chloride අන්තර්ගත නිසා මෙම සාම්පල් කොළ පැහැයෙන් දිස් වේ.
ඉතිහාසය[සංස්කරණය]
17 වන ශතවර්ශයේ මැද භාගයේ දී රොබර්ට් බොයිල් විසින් ප්රථම වරට මෙම සංයෝගය Mercury(II) Chloride හා කොපර් metal භාවිතයෙන් සොයා ගනු ලැබීය.
HgCl2 + 2Cu ----> 2CuCl + Hg
J. L. Proust විසින් කොපර් හි එකිනෙකට වෙනස් ක්ලෝරයිඩ 2ක් විස්තර කරන ලදි. මොහු CuCl2 වෙත වාතය නොමැති මාද්යයක් ක් තුල රක්ත තාපය සැපයීම තුලින් CuCl නිපදවන ලදි. මෙහිදී එක් ක්ලෝරීන් පරමාණුවක් ඉවත් වන අතර ඉතිරි CuCl2 ජලය මගින් සෝදා ඉවත් කරනු ලැබේ. CuCl වල ආම්ලික ද්රාවණ, වායූන්වල කාබන් මොනොක්සයිඩ් අන්තර්ගතය විශ්ලේෂණය කිරීමට අතීතයේ භාවිතා කරන ලදි. උදාහරණයක් වශයෙන් Hempal’s වායු උපකරණය දැක්විය හැක. තාපය හා ආලෝකය සඳහා ගල් අඟුරු වායුව බහුලව භාවිතා කල 19 හා 20 වන ශත වර්ශ වල මෙම සේදීම ඉතා වැදගත් විය.
රසායනික ගුණ[සංස්කරණය]
-
තඹ කම්බිය මත සුඩු පැහැති
-
ඇස්කොබික් අම්ලය සමග කොපර්(II) chloride පිරියම් කොට කොපර්(I) chlorid නිපදවීම
-
කොපර්(I) chloride අර්ධ වශයෙන් වාතයේ ඔක්සිකරණය කල විට
කොපර් ක්ලෝරයිඩ් ලෙවිස්(Lewis) අම්ලයක් වන අතර එය මෘදු අම්ලයක් ලෙස Hard-Soft Acid Base ස්ංකල්පයට අනුකූලව වර්ගීකරනය කල හැක.එලෙසම මෙය Triphenylphosphine මෘදු Lewis මාද්යයක් තුල මිශ්රණය වී පැවතීමට නැඹුරුතාවක් දක්වයි.
උදා:-
CuCl + P(C6H5)3 → [CuCl(P(C6H5)3)]4
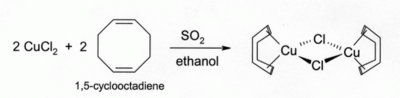
CuCl ජලයේ දිය නොවන නමුත් සුදුසු දායක අණු අඩංගු වන ජලීය මාධ්යයක ද්රාවණය වේ.එලෙසම හේලයිඩ් අයණ සමඟ ද මිශ්රණය වේ. උදාහරනයක් ලෙස H3O+ හා CuCl2 සාන්ද්ර HCl අම්ලය සමඟ CuCl CN-, S2O32-, වලට NH3 පහර දී අනුරූප මිශ්රණයක්ද සාදනු ලබයි. CuCl ද්රාවණ HCl හා NH3 මාද්යය තුලදී කාබන් මොනොක්සයිඩ් අවශෝෂණය කරගෙන ක්ලෝරීන් හා බැඳුනු ද්වී අණුවක් වැනි අවර්ණ ද්රාවණයක් සාදයි. එම HCl ද්රාවණයම ඇසිටිලීන් වායුව සමඟ ප්රතික්රියා කර [CuCl(C2H2)] සාදයි. CuCl වල ඇමෝනීය ද්රාවණ ඇසිටිලීන් වායුව සමඟ ප්රතික්රියා කර පුපුරණ සුලු කොපර්(I) ඇසිටිලයිඩ් Cupper(I) Chloride සාදයි. ඇල්කේන සහිත ඇල්කොහොල් ද්රාවණයක් තුල සල්ෆර් ඩයොක්සයිඩ් CuCl2 මගින් ඔක්සිහරණය කිරීමෙන් ඇල්කේන සහිත C ද්රාවණයක් සාදා ගත හැක. 1,5 - cyclooctadiene මෙන් ඩයි ඊන සමඟ සාදන ද්රාවණ ප්රධාන වශයෙන් ස්ථායී තත්වයේ පවතී.
CuCl ද්රාවණ ස්ථාවර ද්රාවණ නොවන නිසා වෙනත් අණු නොමැති මාද්යයකදී එය ද්විධාරකරණය වී Cu හා CuCl2 යන ස්ථායී සංයෝග සාදයි. එමනිසා සමහර CuCl සාම්පල වාතයේදී කොල පැහැයෙන් දිස්වේ.
භාවිතය[සංස්කරණය]
කොපර්(1) Chloride මූලික වශයෙන් දිලීර නාශක කොපර් ඔක්සි ක්ලෝරඉඩ් වලදී යොදා ගනී.මේ සදහා ජලීය කොපර්(1) Chloride,Comproportionation ක්රියාවලියෙන් පසුව ඔක්සිකරණය කීරීම තුලින් නිපදවා ගනී.Arenediazonuium Salt සමඟ CuCl පිරියම් කල විට ඇරිල් ක්ලෝරඉඩ නිපද වේ.
Cu + CuCl2 → 2 CuCl
6 CuCl + 3/2 O2 + 3 H2O → 2 Cu3Cl2(OH)4 + CuCl2
ඉහත දැක්වූ ආකාරයට කොපර්(1) Chloride බොහෝ කාබනික ප්රතික්රියා වලදී උත්ප්රේරකයක් ලෙස භාවිත කරයි.තවද COPureSM ක්රියාවලියේදී මෙම කොපර්(1) Chloride උත්ප්රේරකයක් ලෙස භාවිතා කරයි.
කාබනික සංස්ලේශනයන් හීදී[සංස්කරණය]
Sandmeyer ප්රතික්රියව තුලදී Arenediazonium salt සමග CuCl පිරියම් කිරීමෙන් aryl chloride නිපදයි.
උදා:

මෙම ප්රතික්රියාවට පුලුල් විශය ශේත්රයක් අයත් වන අතර හොඳ ඵලයක් ලබා දේ. පැරණි පර්යේශකයින්ගෙ සඳහන් කෙරීම් වලට අනුව කොපර්(1) halides 1,4 ග්රිනාඩ් ප්රතිකාරකයන්ගේ alpha,beta-අසංතෘප්ත කීටෝන වලට එකතු කිරීමේදීද උත්ප්රේරකයක් ලෙස ගනී.මෙය කාබනික සංස්ලේශනයන් හීදී බහුලව භාවිතා වන organocuprate ප්රතිකාරක නිපදවීමට ඉවහල් වේ.
 මෙම සොයාගැනීම organකොපර් රසායන විද්යවේ දියුනුවට ඉවහල් විය. උදා: CuCl,මෙතිල් ලිතියම් සමඟ ප්රතික්රිය කොට (CH3)2CuLi වැනි "Gilman regents" (ගිල්මාන් ප්රතිකාරකයන්) සාදයි.මෙයද විශාල වශයෙන් කාබනික සංස්ලේශනයන් වලදී උපකාර වේ.ග්රිනඩ් ප්රතිකාරක තුල Organoකොපර් සංයෝග වලට සමාන සංයෝග අඩංගු වේ.කෙසේ වෙතත් කොපර්(1) iodide වැනි අනිත් කොපර්(1) සංයෝග මෙවැනි ප්රතික්රියා වලට නිතර භාවිත කරයි.තවද කොපර්(1) chloride සමහර සිද්දීන් වලදී නිර්දේශීව පවතී.
මෙම සොයාගැනීම organකොපර් රසායන විද්යවේ දියුනුවට ඉවහල් විය. උදා: CuCl,මෙතිල් ලිතියම් සමඟ ප්රතික්රිය කොට (CH3)2CuLi වැනි "Gilman regents" (ගිල්මාන් ප්රතිකාරකයන්) සාදයි.මෙයද විශාල වශයෙන් කාබනික සංස්ලේශනයන් වලදී උපකාර වේ.ග්රිනඩ් ප්රතිකාරක තුල Organoකොපර් සංයෝග වලට සමාන සංයෝග අඩංගු වේ.කෙසේ වෙතත් කොපර්(1) iodide වැනි අනිත් කොපර්(1) සංයෝග මෙවැනි ප්රතික්රියා වලට නිතර භාවිත කරයි.තවද කොපර්(1) chloride සමහර සිද්දීන් වලදී නිර්දේශීව පවතී.

මෙහිදී Bu ,n-butyl පංතිය නිරූපනය කරයි.CuCl නොමැති විට ග්රිනඩ් ප්රතිකාරක තනිවම 1,2 සහ 1,4 නිපදවීම් වල එකතුවක මිශ්රණයක් සාදයි.(උද: C=O බන්දනයකට ලඟින් පිහිටි C වෙත butyl එක් වේ)
Wacker process හීදී කොපර්(1) chloride යොදා ගනී.
බහු අවයවික රසායනික විද්යාවේදී[සංස්කරණය]
Atom Transfer Radical Polymerization (ATRP) ක්රියාවලියේදී CuCl උත්ප්රේරකයක් ලෙස යොදා ගනී.
ශීර්ෂ පෙළ[සංස්කරණය]
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
වැඩිදුර කියවීම[සංස්කරණය]
- Mellor, J. W., A Comprehensive Treatise on Inorganic and Theoretical Chemistry, Volume III, pp157-168. Longmans, Green & Co., London, 1967 (new impression).